【题目】部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡 常数(25℃) | Ka=1.77×10-4 | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)室温下①0.1mol·L-1HCOONa;②0.1mol·L-1NaClO;③0.1mol·L-1Na2CO3;④0.1mol·L-1NaHCO3四种溶液的pH由大到小的关系为________________。(用序号填空)
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为________________。
(3)下列离子方程式正确的是___________(填字母)。
A.2ClO-+H2O+CO2=2HClO+CO32- B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.H2SO3+2HCOO-=2HCOOH+SO32- D.Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-
(4)某温度(T℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-=10-ymol·L-1,x与y的关系如图所示。
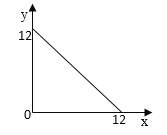
①此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_______。
②在此温度下,0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1mol·L-1的Ba(OH)2 | 10 | 10 | 10 | 10 |
0.1mol·L-1的NaHSO4 | 5 | 10 | 15 | 20 |
按甲方式混合后,所得溶液的pH为____________;
按乙方式混合后,其反应的离子方程式:_________________。
按丁方式混合后,所得溶液显____________(填“酸”“碱”或“中”)性
【题目】氮的氧化物有许多重要的性质与用途,但过量排放则会导致严重的环境问题。
(1)汽车排放出的氮氧化物是导致雾霾形成的重要原因之一,汽车内安装的尾气处理器可大大降低氮氧化物的排放:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=x kJ/mol。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol
2NO(g) ΔH=+180.50kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol
2CO2(g) ΔH=-566.00kJ/mol
x =________________。
(2)向某恒容密闭容器中加入一定量的NO、CO并使它们之间发生反应,下图为在相同温度、压强、比表面积不同的催化剂(化学成分相同)的催化作用下,反应过程中NO的物质的量与时间之间的关系。
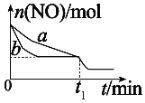
①表示催化剂比表面积较大的曲线是_________(填“a”或“b”)。
②t1min时改变(外界)的反应条件可能是____________。
(3)对于反应:mA(g)+nB(g) =pC(g)+qD(g)来说,若A、B通过一步反应能直接转化为C、D,则该反应的反应速率v=kcm(A)cn(B),其中k为只与温度有关的速率常数;若为可逆反应,则v(正)、v(逆)均存在类似的关系式,k正、k逆也只与温度有关。已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
①________________________________________(快)H1<0。
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)H2<0。
2NO2(g)(慢)H2<0。
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/mol/L | c(O2)/mol/L | v2正[mol/(L·s)] |
0.010 | 0.010 | 1.75 |
0.030 | 0.020 | 1.05 |
x | 0.030 | 1.05 |
i.用k2正表示②的正反应速率常数,则v2正=_________,x=_______,速率常数k2正=_______L·(mol·s)-1(填具体的数值)。
ii.在①的空白处写出化学方程式,若①②两个反应的正、逆反应速率常数分别用k1正、k1逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
(4)在恒温恒容条件下,能表明2NO(g)+O2(g)![]() 2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
a.混合气体密度保持不变 b.混合气体平均摩尔质量不变
c.正反应速率:v(NO)=v(NO2) d.生成NO2、O2的物质的量之比为1:2