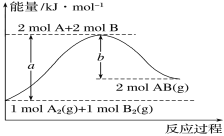
题目内容
【题目】卤素元素是非金属性很强的一类元素,能形成多种物质。
(1)氯气能氧化许多种还原剂,同时在适当条件下又可发生自身氧化还原反应。
①将足量的氯气通入到H2S溶液中,再向所得的溶液中加入用盐酸酸化的BaCl2溶液可得到白色沉淀,写出前一个反应的离子方程式___________________________________。
②将0.1molCl2缓慢通入到amL、浓度为2mol/L的KOH溶液中,二者恰好反应完,测得溶液c(ClO-):c(ClO3-):c(Cl-)=2:1:7,则a=_________。
(2)KClO3是一种重要的氧化剂,工业上制备KClO3的方法之一如下:
![]()
①写出电解时反应的化学方程式_____________________________________________。
②相同温度下,两种氯酸盐的溶解度相对大小:NaClO3_____KClO3(填“>”或“<”)。
③KClO3在MnO2的催化作用下加热分解生成氧气的反应历程如下,请补上空白处:
2KClO3+2MnO2 ![]() 2KMnO4+Cl2↑+O2↑,2KMnO4
2KMnO4+Cl2↑+O2↑,2KMnO4 ![]() K2MnO4+MnO2+O2↑,
K2MnO4+MnO2+O2↑,
K2MnO4 + Cl2=O2↑+______________+_______________。
反应结束后将固体混合物分离开的主要操作是________________________。
(3)已知Cl2O是酸性氧化物,将Cl2O通入到水中可得到一种酸性溶液,请写出该溶液具有的除酸性外的一种化学性质___________________。若将该气体通入到NaOH溶液中恰好完全反应,则溶液中各离子浓度由大到小的顺序为_____________________。
(4)有同学计划用2L的食盐水将AgCl固体中所含有的1molAg2CO3转化为AgCl,列式求出此转化的平衡常数__________________________(已知Ksp(AgCl)=1.8×10-10、Ksp(Ag2CO3)=8.4×10-12)。
【答案】4Cl2+H2S+4H2O=10H++SO42-+8Cl- 100 NaCl+3H2O![]() NaClO3+3H2↑ > 2KCl MnO2 溶解、过滤、洗涤、蒸发结晶 漂白性或强氧化性等 c(Na+)>c(ClO-)>c(OH-)>c(H+) 2.6×108
NaClO3+3H2↑ > 2KCl MnO2 溶解、过滤、洗涤、蒸发结晶 漂白性或强氧化性等 c(Na+)>c(ClO-)>c(OH-)>c(H+) 2.6×108
【解析】
(1)①由实验现象知H2S被氯气氧化为SO42-,由此可写出相应的离子方程式:4Cl2+H2S+4H2O=10H++SO42-+8Cl-;
②由于Cl2与KOH溶液反应后生成了三种盐KCl、KClO3、KClO,故n(K+)=2n(Cl2)=0.2mol,因此a=100mL。
(2)①由流程图知,电解NaCl溶液时得到NaClO3溶液,氯元素的化合价升高,阴极上是氢离子得到电子转化为氢气,相应的电解方程式为NaCl+3H2O![]() NaClO3+3H2↑。
NaClO3+3H2↑。
②由于钠盐、钾盐均可溶于水,向NaClO3溶液中加入KCl后得到KClO3,由此可知KClO3的溶解度比NaClO3的溶解度小。
③由于MnO2是催化剂,最终产物是KCl与氧气,故第三步应该有KCl、MnO2生成,由此可确定第三步的化学方程式。混合物中的KCl易溶于水而MnO2不溶于水,故可采用先溶解、再过滤并洗涤固体MnO2,然后蒸发除去水得到KCl固体的方法将二者分离开。
(3)由题目所给出的信息知Cl2O可以与水反应生成HClO,与NaOH溶液反应生成NaClO,HClO溶液具有强氧化性、漂白性;NaClO是强碱弱酸盐,由此可确定离子浓度的相对大小为c(Na+)>c(ClO-)>c(OH-)>c(H+)。
(4)Ag2CO3+2Cl![]() 2AgCl+CO32-,K=
2AgCl+CO32-,K=![]() =
=![]() =
=![]() =2.6×108
=2.6×108

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列有关实验装置、操作中不能实现相应实验目的的是 ( )
A | B | C | D | |
装 置 |
|
|
|
|
目的 | 证明AlCl3是共价化合物 | 证明在NaOH的乙醇溶液中加热溴乙烷时有乙烯生成 | 证明氯气氧化性强于I2 | 比较Ksp(AgCl)、Ksp(AgBr)的相对大小 |
A.AB.BC.CD.D
【题目】目前工业上可利用 CO 或 CO2 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三 个化学反应进行了探究。已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示。
化学反应 | 焓变 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是_____(填“吸热”或“放热”)反应;反应③的平衡常数表达式为 K=_____;
(2)根据反应①与②可推导出 K1、K2 与 K3 之间的关系,则 K3=_____(用 K1、K2 表示);根据反应③判断ΔS_____(填“>”“=”或“<”)0,在_____(填“较高”或“较低”)温度下有利于该反应自 发进行。
(3)要使反应③在一定条件下建立的平衡逆向移动,可采取的措施有___________ (填字母,后同)。
A.缩小反应容器的容积 B.增大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.从平衡体系中及时分离出 CH3OH
(4)500 ℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为 0.1 mol·L-1、0.8 mol·L-1、0.3 mol·L-1、0.15 mol·L-1,则此时 v(正)__________ v(逆)(填“>”“=”或“<”)。