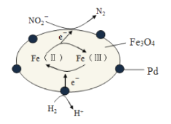
题目内容
【题目】以黄铜矿(主要成分为铁、铜、硫三种元素组成的化合物)为基本原料,通过一系列的冶炼可得到铜、铁、SO2、SO3、H2SO4等物质,回答下列问题:
(1)基态铁原子价层电子排布式为____________,基态硫原子的核外电子共有_______种不同的能量。硫元素所在周期的非金属元素第一电离能由大到小的顺序为__________。
(2)SO2、SO3、H2SO4中,硫原子的杂化轨道类型为sp3的物质是________,SO2的分子构型是____________,属于非极性分子的氧化物是___________。
(3)在溶液中Cu2+易与水形成[Cu(H2O)6]2+而显蓝色,向相应的溶液中加入足量的氨水可得到[Cu(NH3)4(H2O)2]2+,则[Cu(NH3)4(H2O)2]2+中Cu2+的配位数是________________,氧铜配位键与氮铜配位键相比,较稳定的是___________________。
(4)氧化铜的熔点为1326℃、沸点为1800℃;氧化亚铜的熔点为1235℃、沸点为1100℃,试解释导致这种差异最可能的原因是___________。
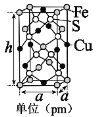
(5)由铁、铜、硫形成的某种化合物的晶胞是一个长方体,结构如图所示,则该化合物的化学式为____________。若晶体密度为dg·cm﹣3,则晶胞的高h=_______pm(写出简化后的计算式即可)。
【答案】3d64s2 5 Ar>Cl>P>S>Si H2SO4 V形 SO3 6 氮铜配位键 CuO中的离子键强于Cu2O中的离子键 CuFeS2 ![]()
【解析】
(1)铁是26号元素,其基态原子价层电子排布为:3d64s2。电子的能量是由能层、能级两种因素所决定的,基态硫原子的电子占据了5个能层,故其电子共有5种不同的能量。同一周期从左到右,元素的第一电离能逐渐增大,但磷由于3p轨道为半充满结构,故其第一电离能大于硫,故有Ar>Cl>P>S>Si。
(2)SO2、SO3、H2SO4三种分子中,硫原子的孤电子对数分别为1、0、0,σ键键数分别为2个、3个、4个,故杂化轨道类型分别为sp2、sp2、sp3,SO2分子是V形分子、SO3分子属于非极性分子。
(3)在[Cu(H2O)6]2+转化为[Cu(NH3)4(H2O)2]2+的过程中,一部分NH3代替了H2O,故氧铜配位键更稳定,其中[Cu(NH3)4(H2O)2]2+中Cu2+的配位数是6。
(4)两种铜的氧化物均属于离子晶体,CuO中的铜离子带两个单位的正电荷而Cu2O中的铜离子只带一个单位的正电荷,CuO中的离子键强于Cu2O中的离子键,从而导致其熔点较高。
(5)晶胞中8个硫原子位于晶胞的内部,铜原子有6个位于面上、4个位于棱上,铜原子数目 = 6×![]() +4×
+4×![]() =4,铁原子有4个位于面上、1个位于内部、8个位于顶点上,铁原子数目 = 4×
=4,铁原子有4个位于面上、1个位于内部、8个位于顶点上,铁原子数目 = 4×![]() +1+8×
+1+8×![]() =4,晶体中Cu、Fe、S原子数目之比 = 4:4:8 = 1:1:2,故该晶体的化学式为:CuFeS2。一个晶胞中含有4个“CuFeS2”,故晶胞质量 =
=4,晶体中Cu、Fe、S原子数目之比 = 4:4:8 = 1:1:2,故该晶体的化学式为:CuFeS2。一个晶胞中含有4个“CuFeS2”,故晶胞质量 =![]() ,晶胞体积 =
,晶胞体积 =![]() ,故有
,故有![]() ,所以h=
,所以h=![]() =
=![]() pm。
pm。

【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
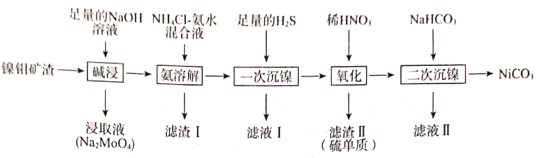
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
【题目】氮的氧化物有许多重要的性质与用途,但过量排放则会导致严重的环境问题。
(1)汽车排放出的氮氧化物是导致雾霾形成的重要原因之一,汽车内安装的尾气处理器可大大降低氮氧化物的排放:2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=x kJ/mol。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=+180.50kJ/mol
2NO(g) ΔH=+180.50kJ/mol
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00kJ/mol
2CO2(g) ΔH=-566.00kJ/mol
x =________________。
(2)向某恒容密闭容器中加入一定量的NO、CO并使它们之间发生反应,下图为在相同温度、压强、比表面积不同的催化剂(化学成分相同)的催化作用下,反应过程中NO的物质的量与时间之间的关系。
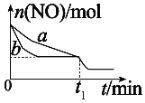
①表示催化剂比表面积较大的曲线是_________(填“a”或“b”)。
②t1min时改变(外界)的反应条件可能是____________。
(3)对于反应:mA(g)+nB(g) =pC(g)+qD(g)来说,若A、B通过一步反应能直接转化为C、D,则该反应的反应速率v=kcm(A)cn(B),其中k为只与温度有关的速率常数;若为可逆反应,则v(正)、v(逆)均存在类似的关系式,k正、k逆也只与温度有关。已知反应:2NO(g)+O2(g)![]() 2NO2(g)是通过下面两步完成的:
2NO2(g)是通过下面两步完成的:
①________________________________________(快)H1<0。
②N2O2(g)+O2(g)![]() 2NO2(g)(慢)H2<0。
2NO2(g)(慢)H2<0。
某科研小组测量出反应②的部分实验数据如下表所示:
c(N2O2)/mol/L | c(O2)/mol/L | v2正[mol/(L·s)] |
0.010 | 0.010 | 1.75 |
0.030 | 0.020 | 1.05 |
x | 0.030 | 1.05 |
i.用k2正表示②的正反应速率常数,则v2正=_________,x=_______,速率常数k2正=_______L·(mol·s)-1(填具体的数值)。
ii.在①的空白处写出化学方程式,若①②两个反应的正、逆反应速率常数分别用k1正、k1逆、k2正、k2逆表示,则2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
2NO2(g)的平衡常数K=____________(用速率常数表示);反应达到平衡后升高温度,在新平衡建立前,体系内c(N2O2)的大小变化情况是________。
(4)在恒温恒容条件下,能表明2NO(g)+O2(g)![]() 2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
2NO2(g)(只考虑总反应)己达到平衡状态的是_____________。
a.混合气体密度保持不变 b.混合气体平均摩尔质量不变
c.正反应速率:v(NO)=v(NO2) d.生成NO2、O2的物质的量之比为1:2