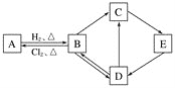
【题目】硒和碲的单质是重要的高新技术材料。一种以含贵重金属的“酸泥”(含Se、Te、Ag、Pb、Cu等单质)为原料制备硒和碲的工艺流程如图所示。
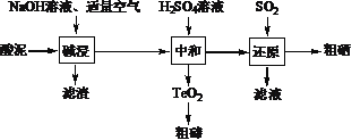
已知:①H2SeO3易溶于水,TeO2不溶于水。
②“中和”过程中测得不同pH下相关数据如下表:
“中和”终点pH | 滤液/(g·L-1) | 沉淀率/% | ||
Se | Te | Se | Te | |
4 | 11.2 | 0.029 | 8.9 | 98.1 |
5 | 13.7 | 0.01 | 5.8 | 98.9 |
6 | 12.4 | 0.013 | 4.1 | 91.6 |
回答下列问题:
(1)已知“碱浸”过程中生成了Na2SeO3和Na2TeO3,则“滤渣”中含有Cu和__。写出Se参加反应的离子方程式____。
(2)“碱浸”过程中通入空气应适量的原因是___。
(3)“中和”过程中生成TeO2的化学方程式是____。
(4)“中和”终点pH应选择在____附近,原因是___。
(5)“滤液”可返回____工序循环使用。
(6)要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2____L。
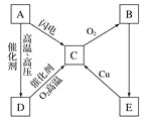
【题目】在T℃条件下,向1L固定体积的密闭容器M中加入2molX和1molY,发生如下反应:2X(g)+Y(g)![]() a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
a Z(g)+W(g) ΔH=-890kJ·mol-1(a为正整数)。
当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为_____。
(2)温度维持T ℃不变,若起始时向容器M中加入4molX和6molY,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为___kJ。
(3)温度维持T ℃不变,若在一个和原容器体积相等的恒压容器N中,加入2molX和1 molY发生如上反应并达平衡,则容器中X的质量分数M___N(选填>、<、=符号)。
(4)已知:该反应的平衡常数随温度的变化如表:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2molX和1molY在容器M中反应达平衡, X的平衡转化率为50%,则该温度为_____℃。平衡时 X的体积分数为____。
【题目】苯甲酸(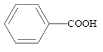 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(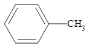 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
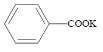 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
实验装置(部分夹持装置已略去)和流程如下:
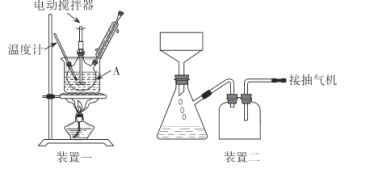
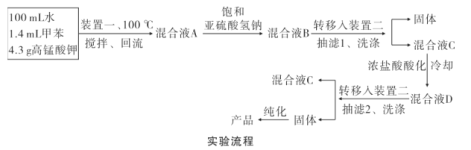
请回答:
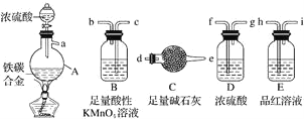
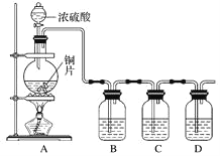
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。