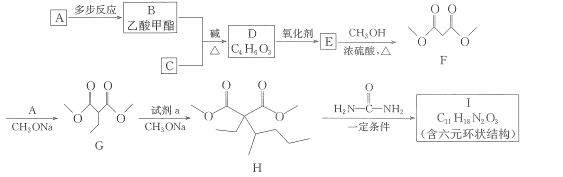
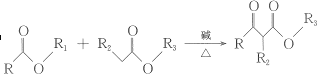
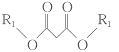
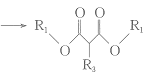
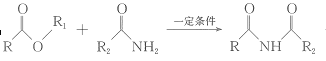题目内容
【题目】某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置。
请回答下列问题:
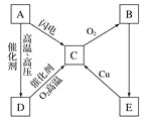
(1)铜和浓硫酸反应的化学方程式为___。
(2)B瓶中盛有品红溶液,观察到品红溶液退色,这是因为SO2具有__(填字母,下同),C瓶中盛有新制的氯水,观察到氯水退色,这是因为SO2具有__。
A.氧化性 B.还原性 C.漂白性
(3)D瓶中盛有NaOH溶液,作用是___。
(4)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片溶解,可再加入__(填字母)。
A.HNO3 B.NaNO3 C.Fe2O3 D.Na2CO3
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O C B 吸收尾气,防止污染 ABC
CuSO4+SO2↑+2H2O C B 吸收尾气,防止污染 ABC
【解析】
本题的实验目的是探究SO2的漂白性和还原性。A为SO2的发生装置,B、C为探究性质装置,D为尾气处理装置。整体难度不大,根据所学知识作答即可。
(1)铜和浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)B瓶中的品红溶液褪色说明SO2具有漂白性,故选C;C中新制氯水褪色,是因为Cl2和SO2发生了氧化还原反应,SO2体现了还原性,故选B;
(3)D瓶中的NaOH溶液,是用来吸收剩余的SO2,防止污染空气;
(4)铜和浓硫酸的反应,随着反应的进行,浓硫酸会变为稀硫酸,反应停止发生,故该反应中铜和硫酸都不能完全反应,反应后烧瓶中仍有铜和硫酸,则:
A、加入HNO3,剩余的铜可以和HNO3继续反应,将剩余的铜片溶解,A符合题意;
B、反应后烧瓶中仍有硫酸,加入NaNO3,相当于加入HNO3,则剩余的铜片会溶解,B符合题意;
C、加入的Fe2O3会被剩余的硫酸溶解生成Fe3+,Fe3+会和剩余的铜片反应,C符合题意;
D、加入的Na2CO3会和剩余的硫酸反应,对剩余的铜片没有影响,D不符合题意;
故选ABC。

 阅读快车系列答案
阅读快车系列答案【题目】CS2是一种常见溶剂,还可用于生产人造粘胶纤维等。回答下列问题:
(1)CS2与酸性KMnO4溶液反应,产物为CO2和硫酸盐,该反应中还原剂与氧化剂的物质的量之比为__________(MnO4-被还原为Mn2+)。
(2)甲烷硫磺法制取CS:的反应为CH4(g)+2S2(g)![]() CS2(g)+2H2S(g) △H
CS2(g)+2H2S(g) △H
①在恒温恒容密闭容器中进行该反应时,能说明该反应已达到平衡状态的是_________(填字母)。
A.v正(S2)=2v逆(CS2)
B.容器内气体的密度不再随时间变化
C.容器内气体的总压强不再随时间变化
D.单位时间内断裂C-H键数目与断裂H-S键数目相等
②已知下列键能数据:
共价键 | C-H | S=S | C=S | H-S |
键能/ | 411 | 425 | 573 | 363 |
该反应的△H=_________kJ·mol-1。
(3)在一密闭容器中,起始时向该容器中充入H2S和CH4且n(H2S):n(CH4)=2:1,发生反应:CH4(g)+2H2S(g)![]() CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
CS2(g)+4H2(g)。0.1MPa时,温度变化对平衡时产物的物质的量分数的影响如图所示:
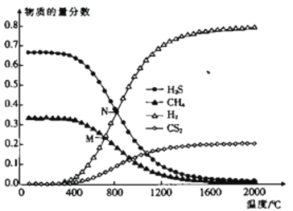
①该反应△H_________(填“>”或“<”)0。
②M点对应温度下,H2S的平衡转化率为_________,为提高H2S的平衡转化率,除改变温度外,还可采取的措施是___________________________(列举一条)。
③N点,平衡分压p(CS2)=_________MPa,对应温度下,该反应的Kp=_________(MPa)2。(Kp为以分压表示的平衡常数)