题目内容
【题目】现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的还原产物,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题:
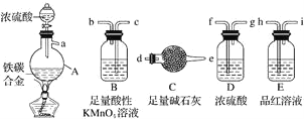
(1)该装置的连接顺序a___(填接口字母),连接好装置后,首先应进行的操作是____。
(2)mg铁碳合金中加入浓H2SO4,点燃酒精灯一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:A:只含有Fe3+;B:只含有Fe2+;C:____,若为A,则A中反应的化学方程式为___,验证C种可能的实验方法___。
(3)待A中不再逸出气体时,停止加热,拆下C并称重,C增重bg。铁碳合金中铁的质量分数____(写表达式)。
(4)某同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____。
(5)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____。
【答案】hicbfgde 检查装置气密性 既有Fe2+,又有Fe3+ 2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+
CO2↑+2SO2↑+2H2O 取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+ ![]() 反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高 Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+
反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高 Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+
【解析】
(1)铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁、二氧化硫和水;碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,二氧化硫具有漂白性,应先检验二氧化硫,用品红溶液,然后用过量高锰酸钾除去二氧化硫,用浓硫酸干燥后,剩余二氧化碳被碱石灰吸收,故连接顺序为:a hicbfgd e;在进行气体制备实验前,应先检查装置气密性;故答案为:hicbfgd e;检查装置气密性
(2)浓硫酸具有氧化性,与铁反应生成Fe3+,随着反应的进行浓硫酸浓度减小,逐渐变为稀硫酸,若铁足量,与稀硫酸反应生成Fe2+,若铁过量,过量的铁与Fe3+反应生成Fe2+,因此反应后的溶液中含有的金属离子成分可能有三种:A:只含有Fe3+;B:只含有Fe2+;C:既有Fe2+,又有Fe3+;铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁、二氧化硫和水;碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则A中反应的化学方程式为:2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,验证第三种可能的实验方法:取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+。
CO2↑+2SO2↑+2H2O,验证第三种可能的实验方法:取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+。
答案为:既有Fe2+,又有Fe3+;2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+;
CO2↑+2SO2↑+2H2O;取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+;
(3)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下C装置并称重,C增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量=![]() ×12g/mol=
×12g/mol=![]() g,则含铁的质量为mg-
g,则含铁的质量为mg-![]() g,铁的质量分数=
g,铁的质量分数=![]() ×100%=
×100%=![]() ×100%。
×100%。
答案为:![]() ×100%
×100%
(4)反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高,故答案为:反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高;
(5)浓硫酸具有氧化性,与铁反应生成Fe3+,随着反应的进行浓硫酸浓度减小,逐渐变为稀硫酸,若铁足量,与稀硫酸反应生成Fe2+,若铁过量,过量的铁与Fe3+反应生成Fe2+,还可能发生的离子反应为:Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;
答案为:Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;

【题目】根据SO2通入不同溶液中的实验现象,所得结论不正确的是( )
溶液 | 现象 | 结论 | |
A | 含HCl,BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2是酸性氧化物 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有还原性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
A.AB.BC.CD.D
【题目】下表是元素周期表中的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | E | F | G | H | J | |||
3 | B | C | D | I |
根据A-J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是_________________,氧化性最强的单质是___________。
(2)常温常压下,1g A单质完全燃烧生成液态水时放出的热量为Q kJ,写出该反应的热化学方程式______________。
(3)B、G、I简单离子半径由大到小的顺序是____________。
(4)A、G、I形成有漂白性的化合物的电子式是___________。
(5)由A、F、G、H四种元素中的三种组成一种强酸,该强酸的稀溶液能与金属铜反应,该反应的化学方程式是___________________。
(6)B最高价氧化物对应的水化物与D最高价氧化物对应的水化物反应的离子方程式是_______。
【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D