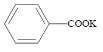
题目内容
【题目】苯甲酸(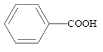 )广泛应用于制药和化工行业。某小组同学尝试利用甲苯(
)广泛应用于制药和化工行业。某小组同学尝试利用甲苯(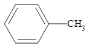 )的氧化反应制备苯甲酸,反应原理为:
)的氧化反应制备苯甲酸,反应原理为:
 +2KMnO4
+2KMnO4![]()
 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O
 +HCl
+HCl![]()
 +KCl
+KCl
相关物质的部分信息如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 沸点/℃ | 密度 /gmL-1 | 溶解度 | |
4℃冷水 | 75℃热水 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.87 | 不溶 | 不溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.27 | 0.18 | 2.20 |
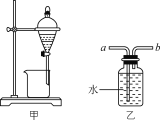
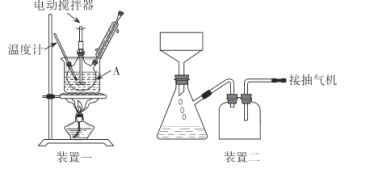
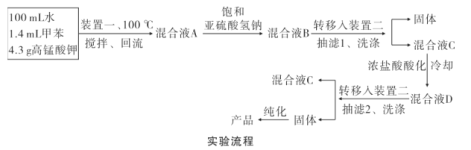
实验装置(部分夹持装置已略去)和流程如下:
请回答:
(1)装置一中A的名称为___,在本实验中,下列规格的A中最合适的是___(填字母)。
A.50 mL B.100mL C.150 mL D.250 mL
(2)相对于用酒精灯直接加热,用热水浴加热的优点是_____。
(3)判断甲苯被氧化完全的实验现象是_____。
(4)抽滤可利用装置二完成,抽滤的优点是____。抽滤1后洗涤固体应选___(填序号,下同),抽滤2后洗涤固体应选_____。
A.4 °C冷水 B.75 °C热水 C.A和B均可
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是_____,若不加入,产生的主要问题是____。
(6)纯化固体时可采用的物理方法的名称是___。
(7)若加入1.4 mL甲苯,纯化后所得产品的质量为1.0 g,则苯甲酸的产率为___。
【答案】三颈烧瓶 D 便于控制温度且受热均匀 三颈烧瓶内液体不分层、回流液不再出现油珠 得到的沉淀较干燥且过滤速度快 B A 除去过量的高锰酸钾 盐酸酸化时会产生氯气 重结晶法 61.7%
【解析】
由反应原理可知,1mol甲苯与2molKMnO4反应,生成1mol苯甲酸钾。由题给数据可知,1.2g甲苯消耗4.1g高锰酸钾,题中高锰酸钾过量。
分析实验流程,可知甲苯、水和高锰酸钾反应回流后,所得混合液A为苯甲酸钾、甲苯、水、高锰酸钾和二氧化锰的混合液,加入饱和的亚硫酸氢钠,可除去过量的高锰酸钾,之后可得混合液B,可知混合液B的成分为:苯甲酸钾、二氧化锰、硫酸钠、硫酸钾、硫酸锰和水。将混合液B趁热抽滤,用少量热水洗涤滤渣,除去MnO2,得到的混合液C为:苯甲酸钾、硫酸钠、硫酸钾、硫酸锰和水的混合物。合并滤液和洗涤液。于冰水浴中冷却,然后用浓盐酸酸化,至苯甲酸析出完全,将析出的苯甲酸减压过滤,用少量冷水洗涤,挤压去水分,将制得的固体提纯可到到较为纯净的苯甲酸。据此进行分析。
(1)由实验装置图可知,A装置为三颈烧瓶。根据加热时,蒸馏烧瓶内的液体不得超过烧瓶容积的![]() ,可知实验中规格为250mL的三颈烧瓶最合适,答案为:三颈烧瓶;D;
,可知实验中规格为250mL的三颈烧瓶最合适,答案为:三颈烧瓶;D;
(2)相比酒精灯直接加热,水浴加热物质受热均匀且便于控制温度。答案为:便于控制温度且受热均匀;
(3)甲苯不溶于水,密度比水小,当其完全被氧化时,溶液中有机层消失,可看到三颈烧瓶中没有分层现象,且回流液没有油珠。故答案为:三颈烧瓶内液体不分层、回流液不再出现油珠;
(4)抽滤是利用真空泵或抽气泵将吸滤瓶瓶中的空气抽走而产生负压,使过滤速度加快,并能使沉淀抽得较干燥;抽滤1后所得的固体为MnO2,为减少苯甲酸钾的损失,可用75℃洗涤MnO2固体,抽滤2后的固体用4℃的冷水洗涤,促进苯甲酸的析出。答案为:得到的沉淀较干燥且过滤速度快;B;A;
(5)混合液A中加入适量饱和亚硫酸氢钠溶液的目的是除去过量的高锰酸钾,若不加入,在浓盐酸酸化步骤中,高锰酸钾会与盐酸发生氧化反应,生成氯气。答案为:除去过量的高锰酸钾;盐酸酸化时会产生氯气;
(6)由题给信息可知,要得到纯净的苯甲酸,可在水中进行重结晶。答案为:重结晶;
(7)根据题给信息,1.4mL甲苯,其质量为![]() ,根据反应方程式,有:
,根据反应方程式,有: ~
~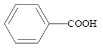
则:![]() ,可得m(
,可得m( )=1.62g,
)=1.62g,
苯甲酸的产率为![]() 。答案为:61.7%。
。答案为:61.7%。