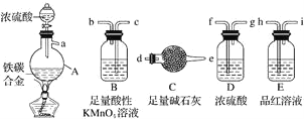
题目内容
【题目】利用光能分解水的装置如图,在直流电场作用下,双极性膜将水解离为H+和OH,并实现其定向通过。下列说法错误的是( )
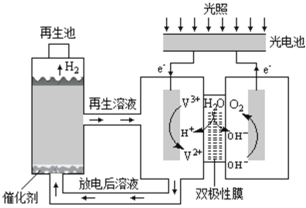
A.光电池能将光能转化为电能
B.阳极区发生的电极反应为:2H2O4e=4H++O2↑
C.双极性膜能控制两侧溶液的酸碱性不同
D.再生池中发生的反应为:2V2++2H+=2V3++H2↑
【答案】B
【解析】
由图上电子的移动方向可知右侧电解池的阳极,反应式为4OH--4e-=2H2O+O2↑,左侧为阴极,反应式为2V3++2e-=2V2+;双极性膜可将水解离为H+和OH-,由图可知,H+进入阴极,OH-进入阳极,放电后的溶液进入再生池中在催化剂条件下发生反应放出氢气,反应方程式为2V2++2H+=2V3++H2↑,由此来解题。
A.由图可知,该装置将光能转化为化学能并分解水,选项A正确;
B.光照过程中阳极区发生的电极反应为:4OH--4e-=2H2O+O2↑,选项B错误;
C.双极性膜可将水解离为H+和OH-,由图可知,H+进入阴极,OH- 进入阳极,则双极性膜可控制其两侧溶液分别为酸性和碱性,选项C正确;
D.根据以上分析,再生的反应方程式为2V2++2H+=2V3++H2↑,选项D正确;
答案选B。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施