题目内容
【题目】硒和碲的单质是重要的高新技术材料。一种以含贵重金属的“酸泥”(含Se、Te、Ag、Pb、Cu等单质)为原料制备硒和碲的工艺流程如图所示。
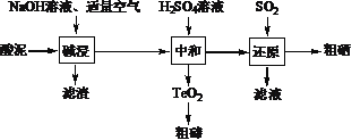
已知:①H2SeO3易溶于水,TeO2不溶于水。
②“中和”过程中测得不同pH下相关数据如下表:
“中和”终点pH | 滤液/(g·L-1) | 沉淀率/% | ||
Se | Te | Se | Te | |
4 | 11.2 | 0.029 | 8.9 | 98.1 |
5 | 13.7 | 0.01 | 5.8 | 98.9 |
6 | 12.4 | 0.013 | 4.1 | 91.6 |
回答下列问题:
(1)已知“碱浸”过程中生成了Na2SeO3和Na2TeO3,则“滤渣”中含有Cu和__。写出Se参加反应的离子方程式____。
(2)“碱浸”过程中通入空气应适量的原因是___。
(3)“中和”过程中生成TeO2的化学方程式是____。
(4)“中和”终点pH应选择在____附近,原因是___。
(5)“滤液”可返回____工序循环使用。
(6)要制取395g粗硒(质量分数为80%),理论上至少应通入标准状况下的SO2____L。
【答案】Ag、Pb Se+2OH-+O2=SeO32-+H2O 过量空气会将Na2TeO3、Na2SeO3氧化 Na2TeO3+H2SO4= Na2SO4+TeO2↓+H2O 5 滤液中Se浓度高,损失少,且Te沉淀率高 中和 179.2
【解析】
由流程知:“酸泥”(含Se、Te、Ag、Pb、Cu等单质)中Se、Te 经过“碱浸”过程被氧化生成了Na2SeO3和Na2TeO3,Ag、Pb、Cu不反应,过滤以后得到的溶液含过量的碱、Na2SeO3和Na2TeO3,“中和”过程中在一定pH下,Na2SeO3和Na2TeO3分别转化为易溶于水的H2SeO3、不溶于水的TeO2,经过滤,把二氧化硫通入滤液中把H2SeO3还原为Se,据此回答;
(1)“碱浸”过程中只有Se、Te被空气中的氧气氧化,生成了可溶性的Na2SeO3和Na2TeO3进入溶液,而Ag、Pb、Cu不反应,则“滤渣”中含有Ag、Pb、Cu;Se参加反应的离子方程式为:Se+2OH-+O2=SeO32-+H2O;
答案为:Ag、Pb;Se+2OH-+O2=SeO32-+H2O;
(2)Se、Te 都位于第ⅥA族,Na2SeO3中的Se和Na2TeO3中的Te都呈+4价,Na2SeO3和Na2TeO3既有氧化性又有还原性,若“碱浸”过程中通入空气过量,则过量空气会将Na2TeO3、Na2SeO3氧化;
答案为:过量空气会将Na2TeO3、Na2SeO3氧化;
(3)“中和”过程中,硫酸和Na2TeO3反应生成硫酸钠、水和TeO2,化学方程式为:Na2TeO3+H2SO4= Na2SO4+TeO2↓+H2O;
答案为:Na2TeO3+H2SO4= Na2SO4+TeO2↓+H2O;
(4)从流程图知,“中和”是分离Se、Te元素的环节,根据中和”过程中测得不同pH下相关的数据知,终点pH应选择在5附近,原因是滤液中Se浓度高,损失少,且Te沉淀率高;
答案为:5;滤液中Se浓度高,损失少,且Te沉淀率高;
(5)“还原”过程是二氧化硫通入滤液中把H2SeO3还原为Se,二氧化硫被氧化生成硫酸,故 “滤液”中含硫酸,可返回中和工序循环使用;
答案为:中和;
(6)二氧化硫通入滤液中把H2SeO3还原为Se的反应为:![]() ,
, ,则
,则![]() =
=![]() ,解得V=179.2L;
,解得V=179.2L;
答案为:179.2L。

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高