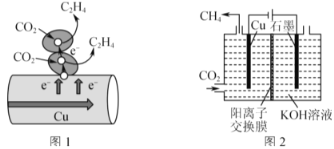
【题目】如图所示,四支电极均为铂电极,供选择的四组电解质溶液如下表:
组 | A | B | C | D |
甲槽 | NaOH溶液 | AgNO3溶液 | H2SO4溶液 | NaCl溶液 |
乙槽 | CuSO4溶液 | CuCl2溶液 | AgNO3溶液 | AgNO3溶液 |
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降;②b、c两极放电离子的物质的量相等。则:
(1)应选用的电解液是________组。
(2)甲槽的电解方程式为:_____________;乙槽的电解方程式为:_______________。
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
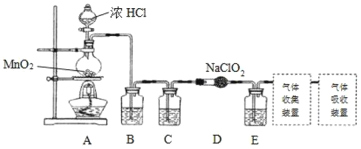
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。