题目内容
【题目】含氯消毒剂有多种,二氧化氯可用于自来水消毒,84消毒液用于家庭、宾馆的消毒。
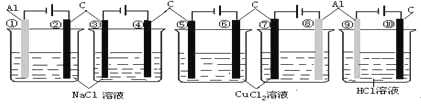
I.实验室可用亚氯酸钠固体与应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl,装置如图所示:
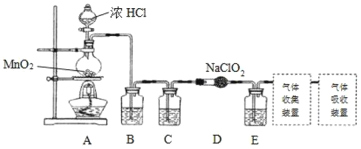
(1)装置A中,盛装浓盐酸的仪器名称为___,开始反应后,圆底烧瓶内发生的反应的离子反应方程式为:__。
(2)已知常温常压下,ClO2和Cl2是气体,在不同溶剂中溶解性如表所示:B、C、E装置中的试剂依次是___(填编号)
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 易溶 |
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.CCl4
(3)使用ClO2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。Fe2+消除ClO2-的离子方程式为__。
II.某同学在家中自制出与“84消毒液”成分(NaClO和水)相同的消毒液。主要器材有6V变压器、两支木杆铅笔、废纯净水瓶、食盐、卫生纸、绝缘胶布、小刀等。
(4)实验过程:向一个废弃的纯净水瓶中灌入大半瓶自来水,并加入3调味匙食盐,用卫生纸将用铅笔做成的电极包好,并插入纯净水瓶中,使电极恰好卡在瓶口,装置如图,接通电源后,可以看到一侧电极无明显现象,另一侧电极有细小的气泡产生,请写出该电极反应式为:___;持续通电约3小时后,发现原先无明显现象的电极附近也开始产生一定量的细小气泡,此电极此时的电极反应式___。看到该现象后停止通电。

(5)用该方法制备消毒液的总化学方程式是:___。
【答案】分液漏斗 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O b、a、d ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+ 2H++2e-=H2↑ 2Cl--2e-=Cl2↑ Cl2+2NaOH=NaClO+NaCl+H2O
Mn2++Cl2↑+2H2O b、a、d ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+ 2H++2e-=H2↑ 2Cl--2e-=Cl2↑ Cl2+2NaOH=NaClO+NaCl+H2O
【解析】
I.由题给信息和实验装置图可知:实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,经除杂、干燥后在D中与亚氯酸钠固体反应生成ClO2,B装置除去氯气中的氯化氢,C装置用浓硫酸进行干燥,因为Cl2易溶于CCl4,E用于除去ClO2中未反应的Cl2,最后收集,并处理尾气。据此进行分析。
II.该实验过程为电解食盐水的反应过程,发生反应:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,根据电解原理,可知刚开始主要产生了氢气,持续通电,另一电极生成了Cl2。Cl2与电解生成的NaOH反应生成NaClO、NaCl和水,据此分析。
2NaOH+Cl2↑+H2↑,根据电解原理,可知刚开始主要产生了氢气,持续通电,另一电极生成了Cl2。Cl2与电解生成的NaOH反应生成NaClO、NaCl和水,据此分析。
(1)根据分析,装置A为浓盐酸和MnO2在加热条件下反应制备Cl2的过程,装置A中,盛装浓盐酸的仪器为分液漏斗,开始反应后发生的离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。答案为:分液漏斗;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O。答案为:分液漏斗;MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)由分析可知,B装置用于除去混在Cl2中的HCl,B装置中的试剂应为饱和食盐水;C装置为干燥装置,试剂为浓硫酸;E装置是用于除去未反应的Cl2,结合题给ClO2和Cl2的性质表格,可知E装置中的试剂应为CCl4。答案为:b、a、d;
(3)根据题给信息,可知Fe2+和ClO2-反应生成了Fe(OH)3和Cl-,其中铁元素的化合价升高,氯元素的化合价降低,根据氧化还原反应中化合价升降总数相等以及原子守恒、电荷守恒等规律,可知该离子方程式为:ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+;答案为:ClO2-+4Fe2++10H2O=4Fe(OH)3+Cl-+8H+;
II.(4)由分析可知,首先在阴极上发生还原反应生成了H2,电极反应方程式为:2H++2e-=H2↑。继续通电,阳极发生氧化反应,生成了Cl2,电极反应方程式为:2Cl--2e-=Cl2↑。答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
(5)生成的Cl2与NaOH发生反应:Cl2+2NaOH=NaClO+NaCl+H2O,答案为:Cl2+2NaOH=NaClO+NaCl+H2O。

 阅读快车系列答案
阅读快车系列答案【题目】下列研究目的和示意图相符的是( )
① | ② | ③ | ④ | |
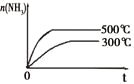
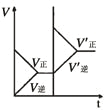
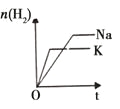
研 | 固定容积的密闭容器中,压强对反应: | 固定容积的密闭容器中,温度对反应: | 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应: | 等质量Na、K 分别与足量水反应 |
示 |
|
|
|
|
A. ①B. ②C. ③D. ④