��Ŀ����
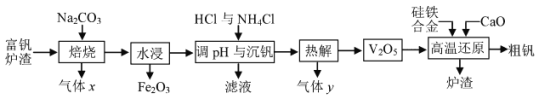
����Ŀ����������Ҫ����ұ�����ָ֣� ����Ϊ ���Ͻ��ά����������ҵ�ϳ��ø���¯�� ����Ҫ��FeO��V2O3�� ��������P2O5�����ʣ� ��ȡ������������ͼ��
�ش��������⣺
(1)��֪�������ȷ���4FeO��V2O3+5O2![]() 4V2O5+2Fe2O3��Ӧ�� ������������__����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪ______��
4V2O5+2Fe2O3��Ӧ�� ������������__����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪ______��
(2)25��ʱ��Ksp(NH4VO3)��4��10-2������ƽ�ⳣ��Kb(NH3��H2O) ��1.8��10-5���������� ��VO3-��Ũ��Ϊ![]() mol/L������Һ��pHΪ___����OH-��VO3-�⣬��Һ�л����ܴ��ڵ���������__��
mol/L������Һ��pHΪ___����OH-��VO3-�⣬��Һ�л����ܴ��ڵ���������__��
(3) ���Ƚ��� ���̲��������� y�ĵ���ʽΪ__��
(4)�������»�ԭ��Ӧ�ķ���ʽΪ_____��¯������Ҫ�ɷ���__��
(5)�������Ľ�����ǿ����ҵ��ͨ����⾫�� ���ַ��� �ɵõ�99.5%�Ĵ����� ������LiCl��KCl��VCl2Ϊ����ʣ����ַ��� �к��������衣�� ���ַ��� Ӧ���ӵ�Դ��___���� �����ĵ缫��ӦʽΪ__��
���𰸡�V2O5��Fe2O3 V2O5��Na2CO3![]() 2NaVO3��CO2�� 4.5 Cl-��H2PO42-��PO43-��HPO42-
2NaVO3��CO2�� 4.5 Cl-��H2PO42-��PO43-��HPO42- ![]() 5Si��2V2O5
5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 CaSiO3 ���� V2+��2e-��V
4V��5CaSiO3 CaSiO3 ���� V2+��2e-��V
��������
�����ǽ�FeO��V2O3ת��Ϊ������NaVO3���������Ͷ�����̼����Ӧ�Ļ�ѧ����ʽΪ��4FeO��V2O3+4Na2CO3+5O2 ![]() 8NaVO3+2Fe2O3+4CO2������xΪCO2��ˮ����������Ϊ���������õ�NaVO3��Һ����Һ�м���NH4Cl��������NH4VO3�����ȷֽ�����V2O5���Ͱ���������ù�����ԭ���������»�ԭ��Ӧ�ķ���ʽΪ5Si��2V2O5
8NaVO3+2Fe2O3+4CO2������xΪCO2��ˮ����������Ϊ���������õ�NaVO3��Һ����Һ�м���NH4Cl��������NH4VO3�����ȷֽ�����V2O5���Ͱ���������ù�����ԭ���������»�ԭ��Ӧ�ķ���ʽΪ5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3��
4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3��
��1���������ȷ���4FeO��V2O3+5O2![]() 4V2O5+2Fe2O3��Ӧ������+2������Ϊ+3�ۣ�����+3������Ϊ+5�ۣ������������� V2O5��Fe2O3����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪV2O5��Na2CO3
4V2O5+2Fe2O3��Ӧ������+2������Ϊ+3�ۣ�����+3������Ϊ+5�ۣ������������� V2O5��Fe2O3����һ�����ɿ�����NaVO3�ķ�Ӧ����ʽΪV2O5��Na2CO3![]() 2NaVO3��CO2�� ���ʴ�Ϊ�� V2O5��Fe2O3��V2O5��Na2CO3
2NaVO3��CO2�� ���ʴ�Ϊ�� V2O5��Fe2O3��V2O5��Na2CO3![]() 2NaVO3��CO2�� ��
2NaVO3��CO2�� ��
��2��25��ʱ��Ksp(NH4VO3)��4��10-2������ƽ�ⳣ��Kb(NH3��H2O) ��1.8��10-5���������� ��VO3-��Ũ��Ϊ![]() mol��L��1��Ksp(NH4VO3)��4��10-2=c(NH4+)c(VO3-)��c(NH4+)=
mol��L��1��Ksp(NH4VO3)��4��10-2=c(NH4+)c(VO3-)��c(NH4+)=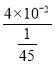 =1.8 mol��L��1,
=1.8 mol��L��1,

Kh=![]() ,x=c(H+)=10-4.5mol��L��1,����Һ��pHΪ4.5����OH-��VO3-�⣬P2O5����ˮ������������H2PO42-��PO43-��HPO42- ����Һ�л����ܴ��ڵ���������Cl-��H2PO42-��PO43-��HPO42- ���ʴ�Ϊ��4.5��Cl-��H2PO42-��PO43-��HPO42- ��
,x=c(H+)=10-4.5mol��L��1,����Һ��pHΪ4.5����OH-��VO3-�⣬P2O5����ˮ������������H2PO42-��PO43-��HPO42- ����Һ�л����ܴ��ڵ���������Cl-��H2PO42-��PO43-��HPO42- ���ʴ�Ϊ��4.5��Cl-��H2PO42-��PO43-��HPO42- ��
��3�����Ƚ��� ���̲��������� y�ǰ�����Nԭ���������5�����ӣ���3����ԭ���γ�3�����õ��Ӷԣ�����ʽΪ![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
��4�������ʱ������ԭ��ͬʱ���ɵĶ����������������γ�¯�����������»�ԭ��Ӧ�ķ���ʽΪ5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3���ʴ�Ϊ��5Si��2V2O5
4V��5CaSiO3 ��¯������Ҫ�ɷ���CaSiO3���ʴ�Ϊ��5Si��2V2O5![]() 4V��5SiO2��5Si��2V2O5��5CaO
4V��5SiO2��5Si��2V2O5��5CaO![]() 4V��5CaSiO3 ��CaSiO3��
4V��5CaSiO3 ��CaSiO3��
��5��������LiCl��KCl��VCl2Ϊ����ʣ����ַ��� �к��������裬 ���ַ��� Ӧ���ӵ�Դ������������������Ӧ�������õ��ӷ�����ԭ��Ӧ�������ĵ缫��ӦʽΪV2+��2e-��V���ʴ�Ϊ������V2+��2e-��V��