��Ŀ����
����Ŀ������˵����ȷ���ǣ�������
A. �Ҵ�ȼ�������������������ڷ�Ӧ���������ķ�Ӧ
B. ϡ��Һ�У�H+��aq��+OH����aq��=H2O��l����H=��57.3 kJ/mol�ɱ�ʾϡ������ϡBa��OH��2��Һ��Ӧ���к���Ϊ��H=��57.3 kJ/mol
C. 2H2S��g��+3O2��g��=2SO2��g��+2H2O��l����H=��QkJ/mol���Ա�ʾH2S��ȼ����
D. �����£�ij��Ӧ�ﵽƽ�⣬ƽ�ⳣ��ΪK=![]() ������ʱ���¶����ߣ�H2Ũ�ȼ�С���ʸ÷�Ӧ���ʱ�Ϊ��ֵ
������ʱ���¶����ߣ�H2Ũ�ȼ�С���ʸ÷�Ӧ���ʱ�Ϊ��ֵ
���𰸡�D
��������
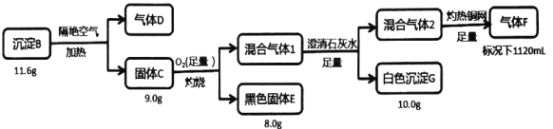
A��ȼ���Ƿ��ȷ�Ӧ����Ӧ�������������������A����
B�����ɳ���ʱ���ȣ�����ϡ������ϡBa��OH��2��Һ��Ӧ���к���Ϊ��H��-57.3 kJ��mol��1����B����
C��ȼ������ָ1mol��ȼ����ȫȼ�������ȶ���������ʱ�ų�����������C����
D�����ݻ�ѧƽ�ⳣ������ʽ��֪��H2Ϊ��Ӧ�����ʱ��Ӧ��Ũ�ȼ�С��˵������ƽ�������ƶ����ʱ�Ϊ��ֵ����D��ȷ��
��ѡD��

����Ŀ����ͼ��ʾ����֧�缫��Ϊ���缫����ѡ�������������Һ���±���
�� | A | B | C | D |
�ײ� | NaOH��Һ | AgNO3��Һ | H2SO4��Һ | NaCl��Һ |
�Ҳ� | CuSO4��Һ | CuCl2��Һ | AgNO3��Һ | AgNO3��Һ |

Ҫ����������ǣ��ٹ���һ��ʱ��ײ۵��ҺpH���������Ҳ۵��ҺpH�½�����b��c�����ŵ����ӵ����ʵ�����ȡ���
(1)Ӧѡ�õĵ��Һ��________�顣
(2)�ײ۵ĵ�ⷽ��ʽΪ��_____________���Ҳ۵ĵ�ⷽ��ʽΪ��_______________��
����Ŀ�������о�Ŀ�ĺ�ʾ��ͼ�������( )
�� | �� | �� | �� | |
�� | �̶��ݻ����ܱ������У�ѹǿ�Է�Ӧ�� | �̶��ݻ����ܱ������У��¶ȶԷ�Ӧ�� | �̶��ݻ����ܱ������У�����CO2Ũ�ȣ����Ѵ�ƽ��ķ�Ӧ�� | ������Na��K �ֱ�������ˮ��Ӧ |
ʾ |
|
|
|
|
A. ��B. ��C. ��D. ��