题目内容
【题目】如图是某条件下N2与H2反应过程中能量变化的曲线图.根据图象判断下列叙述中正确的是( )
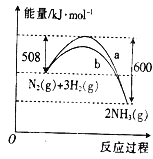
A. 该反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=+92kJ·mol﹣1
2NH3(g) △H=+92kJ·mol﹣1
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应的反应热数值会减小
D. 反应2NH3(g)![]() N2(g)+3H2(g)△H=+92kJ·mol﹣1
N2(g)+3H2(g)△H=+92kJ·mol﹣1
【答案】D
【解析】
A、据图可知,反应物的总能量大于生成物的总能量,所以为放热反应,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol-1,故A错误;
2NH3(g)△H=-92kJ·mol-1,故A错误;
B、催化剂能改变反应的路径,降低发生反应所需的活化能,则b曲线是加入催化剂时的能量变化曲线,故B错误;
C、焓变只与反应物的总能量和生成物的总能量有关,加入催化剂可以降低活化能,反应的热效应不变,故C错误;
D、热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-92kJ·mol-1,则2NH3(g)
2NH3(g)△H=-92kJ·mol-1,则2NH3(g)![]() N2(g)+3H2(g)△H=+92kJ·mol-1,故D正确;
N2(g)+3H2(g)△H=+92kJ·mol-1,故D正确;
答案选D。

【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。
【题目】已知某化学反应的平衡常数表达式为K=![]() ,在不同的温度下该反应的平衡常数如表所示:
,在不同的温度下该反应的平衡常数如表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
下列有关叙述不正确的是( )
A. 该反应的化学方程式是CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B. 上述反应的正反应是放热反应
C. 若在1L的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态
D. 若平衡浓度符合下列关系式:![]() ,则此时的温度为1000℃
,则此时的温度为1000℃
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知如下化学键的键能:
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学键时放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是
A.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=-91.5kJ/mol
Cl2(g)=HCl(g) ΔH=-91.5kJ/mol
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183kJ/mol
C.2HCl(g)=H2(g)+Cl2(g) ΔH=+183kJ/mol
D.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g) ΔH=+91.5kJ/mol
Cl2(g)=HCl(g) ΔH=+91.5kJ/mol


