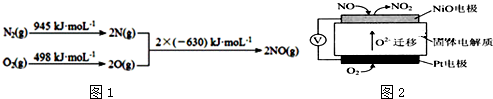1.五种不同元素X、Y、Z、D、E、F的信息如下:
请回答下列问题:
(1)Z在周期表中的位置第三周期第ⅥA族,D的最高价氧化物对应水化物的电子式为
(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是2Fe3++2I-═2Fe2++I2(用离子方程式表示).
(4)E单质在发生吸氧腐蚀时的正极反应方程式O2+2H2O+4e-═4OH-
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
| 元素 | 有关信息 |
| X | 元素主要常见化合价为-2和-1价,原子半径为0.074nm. |
| Y | 所在主族序数与所在周期序数之差为4. |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其气态氢化物与Y单质发生反应生成淡黄色固体. |
| D | 最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子. |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏. |
| F | 元素所在的主族序数等于周期序数. |
(1)Z在周期表中的位置第三周期第ⅥA族,D的最高价氧化物对应水化物的电子式为

(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑.
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是2Fe3++2I-═2Fe2++I2(用离子方程式表示).
(4)E单质在发生吸氧腐蚀时的正极反应方程式O2+2H2O+4e-═4OH-
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理Al3++3H2O═Al(OH)3(胶体)+3H+.
20.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
19.常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是:
( )
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 三种酸的酸性由强到弱为:HF>H2C03>HCN |
18.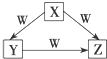 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
( )
 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:| X | Y | Z | W | |
| A | NaOH | Na2CO3 | NaHCO3 | CO2 |
| B | O2 | CO2 | CO | C |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
17.下列实验中,所采取的分离方法与对应原理都正确的是( )
0 172889 172897 172903 172907 172913 172915 172919 172925 172927 172933 172939 172943 172945 172949 172955 172957 172963 172967 172969 172973 172975 172979 172981 172983 172984 172985 172987 172988 172989 172991 172993 172997 172999 173003 173005 173009 173015 173017 173023 173027 173029 173033 173039 173045 173047 173053 173057 173059 173065 173069 173075 173083 203614
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
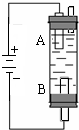 某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题:
某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题: