题目内容
5.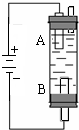 某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题:
某同学设计了一种电解法制取Fe(OH)2的实验装置(如图).玻璃管内的电解液为NaCl溶液,通电后,溶液中产生白色沉淀,且较长时间不变色.回答下列问题:(1)写出A电极的电极反应式Fe-2e-=Fe2+;B电极的电极反应式2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);
(2)若电解改用NaOH溶液作电解液,发现电解一开始即出现灰绿色沉淀,该沉淀产生在A极附近(选填“A”或“B”).试分析为什么用NaCl溶液作电解液时白色沉淀能保持较长时间的原因:B极产生的氢气在上逸时会将体系中空气排出,在溶液的中下部产生沉淀形成液封有利于和空气隔绝.
分析 (1)铁作阳极,阳极上铁失电子发生氧化反应,阴极上氢离子得电子发生还原反应;
(2)氢氧化亚铁不稳定,易被氧化生成氢氧化铁,根据氢氧化亚铁产生的位置分析.
解答 解:(1)铁作阳极,阳极上电极反应式为Fe-2e-=Fe2+,阴极上氢离子得电子生成氢气,电极反应式为:2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑),
故答案为:Fe-2e-=Fe2+;2H2O+2e-=H2↑+2OH-(或2H++2e-=H2↑);
(2)如果改用氢氧化钠溶液,亚铁离子和氢氧根离子在阳极A附近生成氢氧化亚铁沉淀,易被空气氧化,如果电解氯化钠溶液,亚铁离子和氢氧根离子在阴极附近生成氢氧化亚铁,溶液能隔绝空气,所以不易被氧化,
故答案为:A;B极产生的氢气在上逸时会将体系中空气排出,在溶液的中下部产生沉淀形成液封有利于和空气隔绝.
点评 本题考查了电解池原理,根据各个电极上发生的电极反应来分析解答,注意不能根据金属的活泼性判断原电池正负极,要根据失电子的难易程度确定原电池负极,为易错点.

练习册系列答案
相关题目
15.下列实验操作正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 蒸馏时,应使温度计水银球伸入蒸馏烧瓶内液面下 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
16.下列有关实验操作正确的是( )
| A. |  除去Cl2中的HCl 除去Cl2中的HCl | B. | 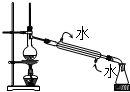 制备蒸馏水 制备蒸馏水 | ||
| C. |  萃取碘水中碘 萃取碘水中碘 | D. |  称量氢氧化钠固体 称量氢氧化钠固体 |
13.下列有关化学用语表达正确的是( )
| A. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| B. | HClO的结构式:H-Cl-O | |
| C. | HF的电子式: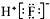 | |
| D. | 35Cl-和37Cl-离子结构示意图均可以表示为: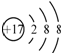 |
20.进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一.下列说法正确的是( )
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 相同质量的铜分别与足量的等体积的浓硝酸和稀硝酸反应,生成溶液分别为绿色和蓝色,是由于反应时产生的铜离子浓度前者大于在后者 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
10.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 129C60中含有NA个电子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1mol/LCaCl2溶液中Cl-的物质的量浓度为0.01mol/L |
17.一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )


| A. | 右边CO与CO2分子数之比为3:1 | |
| B. | 右侧CO的质量为2.75g | |
| C. | 右侧气体密度是相同条件下氧气密度的16倍 | |
| D. | 若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,保持温度不变,则前后两次充入情况容器内的压强之比为24:25 |
14.下列叙述中正确的是( )
| A. | 将SO2通入酸性高锰酸钾溶液中,溶液褪色,不能说明SO2具有漂白性 | |
| B. | 浓盐酸和浓硫酸暴露在空气中浓度都会降低,其原因相同 | |
| C. | 向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42- | |
| D. | 土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性 |
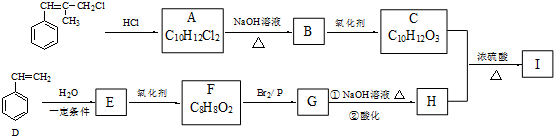
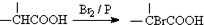
 .
. .
.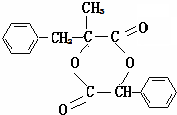 .
. (写结构简式).
(写结构简式).