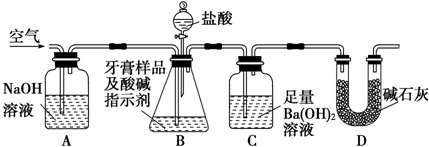
题目内容
3.回答下列问题:(1)某溶液可能呈酸性或碱性,此外还有Na+、SO42-和Cl-,且测得此三种离子的浓度分别是0,.01mol•L-1、0.0035mol•L-1和0.004mol•L-1,该溶液的pH为3.
(2)在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是氢气和氨气.
(3)液氨类似于水的电离,试写出液氨的电离方程式2NH3?NH4++NH2-.
(4)某二元酸(H2A)在水中的电离方程式是:H2A=H++HA-,HA-?H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:A2-+H2O?HA-+OH-.
分析 (1)根据溶液中的电荷守恒来回答计算;
(2)NH4Cl是强酸弱碱盐,在溶液中水解显酸性;
(3)根据水的电离和题给信息结合外界条件对平衡移动的影响分析;
(4)该二元酸第一步完全电离,第二步部分电离,说明A2-能水解、HA-只电离不水解,Na2A水溶液中A2-水解导致溶液呈碱性.
解答 解:(1)任何溶液中均需满足电荷守恒,由于Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01mol•L-1、0.003 5mol•L-1、0.004mol•L-1,溶液中的阴离子所带负电荷的浓度大于阳离子所带正电荷的浓度,故溶液中应含氢离子,即溶液显酸性,则有:c(H+)+c(Na+)=2c(SO42-)+c(Cl-),可知溶液中的c(H+)=0.0035mol/L×2+0.004mol/L-0.01mol/L=0.001mol/L.则溶液的pH=-lgc(H+)=3,故答案为:3;
(2)浓NH4Cl溶液中铵根离子水解导致溶液显示酸性,NH4++H2O?NH3•H2O+H+,加入金属镁,金属镁可以和酸之间反应生成氢气,Mg+2H+═Mg2++H2↑,导致铵根离子的水解平衡右移,一水合氨分解生成氨气,故答案为:氢气和氨气;
(3)液氨类似于水的电离,已知水的电离方程式可写为2H2O?H3O++OH-,则液氨的电离方程式为2NH3?NH4++NH2-,故答案为:2NH3?NH4++NH2-;
(4)该二元酸第一步完全电离,第二步部分电离,说明A2-能水解、HA-只电离不水解,Na2A水溶液中A2-水解导致溶液呈碱性,水解方程式为A2-+H2O?HA-+OH-,故答案为:A2-+H2O?HA-+OH-.
点评 本题考查了弱电解质的电离、盐类水解等知识点,注意(4)中该二元酸两步电离的不同,知道(1)中氢离子浓度的计算方法,为易错点.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | CaO | B. | NaOH | C. | CO2 | D. | Fe3O4 |
| A. | Na+、SO42-、HCO3- | B. | NH4+、SO42-、NO3- | C. | Cu2+、ClO-、NO3- | D. | K+、OH-、Cl- |
| A. | 同位素的应用已经遍及医学、工业、农业、能源和科学研究的各个领域 | |
| B. | iPhone5外壳易掉色,是因为铝壳表面氧化处理过程中作为阳极的金属铝纯度不够,导致氧化膜不够致密 | |
| C. | 在日光照射下,NO2与空气中的一些碳氢化合物发生作用后,产生了光化学烟雾 | |
| D. | 在医疗上硫酸亚铁可用于生产防治缺铁性贫血的药剂,在工业上硫酸亚铁还是生产铁系列净水剂和颜料氧化铁红(主要成分为Fe2O3)的原料 |
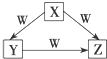 X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:
X、Y、Z、W是中学化学常见的四种物质,它们之间具有如图所示转化关系,则下列组合不可能的是:| X | Y | Z | W | |
| A | NaOH | Na2CO3 | NaHCO3 | CO2 |
| B | O2 | CO2 | CO | C |
| C | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| D | S | SO2 | SO3 | O2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 9倍 | B. | 12倍 | C. | 24倍 | D. | 48倍 |
| A. | 三种气体的分子数目一定相等 | B. | 三种气体物质的量之比为16:2:1 | ||
| C. | 三种气体的密度之比为1:2:16 | D. | 三种气体的压强一定相等 |
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到 224mLCO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如右图所示.