题目内容
2.将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物.(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(2)B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则该方程式为2SO2+O2$?_{△}^{催化剂}$2SO3.已知煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,请写出其反应的化学方程式:SO2+CaO$\frac{\underline{\;\;△\;\;}}{\;}$CaSO3或SO2+2CaO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4.
(3)E能使湿润的红色石蕊试纸变蓝,工业上常用E为原料制取硝酸,写出E催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O; E和氯气接触会产生白烟,利用这一反应,化工厂的工人可用沾有浓氨水的玻璃棒检验输送氯气的管道是否漏气,该反应的化学方程式为8NH3+3Cl2═6NH4Cl+N2
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为NH4Al(SO4)2•12H2O.
分析 晶体X加热分解,可得A、B、D、E、F和水六种产物,A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物,
(1)既能溶于强酸又能溶于强碱的常见氧化物A为Al2O3,氧化铝与氢氧化钠反应生成偏铝酸钠;
(2)由B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则B为SO2,D为SO3;
(3)E能使湿润的红色石蕊试纸变蓝,则E为NH3;氨气与氯气发生氧化还原反应生成氯化铵,可以看到白烟;
(4)X的组成类似于明矾,结合以上分析写出晶体X的化学式.
解答 解:晶体X加热分解,可得A、B、D、E、F和水六种产物,A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物,
(1)既能溶于强酸又能溶于强碱的常见氧化物A为Al2O3,氧化铝与氢氧化钠反应生成偏铝酸钠,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)由B、D都是酸性氧化物且组成元素相同,B是形成酸雨的主要原因,B在一定条件下可以转化为D,则B为SO2,D为SO3,反应方程式为2SO2+O2$?_{△}^{催化剂}$2SO3,煤燃烧所产生的烟气中含有B,若在煤中掺入适量生石灰,可减少B的排放,其反应的化学方程式为SO2+CaO$\frac{\underline{\;\;△\;\;}}{\;}$CaSO3或 SO2+2CaO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;SO2+CaO$\frac{\underline{\;\;△\;\;}}{\;}$CaSO3或 SO2+2CaO+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CaSO4;
(3)E能使湿润的红色石蕊试纸变蓝,则E为NH3,氨的催化氧化的方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,氨气与氯气发生氧化还原反应生成氯化铵,可以看到白烟,反应方程式为8NH3+3Cl2═6NH4Cl+N2,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;8NH3+3Cl2═6NH4Cl+N2;
(4)X的组成类似于明矾,结合以上分析可知晶体X的化学式为NH4Al(SO4)2•12H2O,
故答案为:NH4Al(SO4)2•12H2O.
点评 本题考查无机物推断、未知物的检验,题目难度中等,注意掌握常见元素及其化合物的性质,正确理解题中信息是解题关键,要求学生具备扎实基础知识和一定的分析、推理能力.

 阅读快车系列答案
阅读快车系列答案| A. | 苯和酒精 | B. | 四氯化碳和溴 | C. | 苯和水 | D. | 醋酸和水 |
| A. | 电离方程式:Na2SO4═Na2++SO42- | B. | 氯化钠的电子式: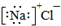 | ||
| C. | 14C的原子结构示意图: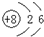 | D. | CH4分子的比例模型: |
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
(1)为洗涤(NH4)2SO4•FeSO4•6H2O粗产品,下列方法中最合适的是D.
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
(2)为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol•L-1的酸性KMnO4溶液滴定.每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低.
| A. | 3.0×1023 | B. | 3.0×1024 | C. | 7.5×1022 | D. | 7.5×1023 |
| A. | 242.5kJ•mol-1 | B. | 286.5kJ•mol-1 | C. | 198.5kJ•mol-1 | D. | 573kJ•mol-1 |

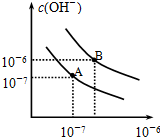 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: