题目内容
17.下列实验中,所采取的分离方法与对应原理都正确的是( )| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.应利用二者溶解度随温度的变化不同分离;
B.氯气难溶于饱和食盐水,HCl易溶;
C.小苏打受热分解生成苏打;
D.碘易溶于CCl4,用蒸馏的方法分离.
解答 解:A.根据二者在水中随温度升高而溶解度不同,利用重结晶法.NaCl随温度升高溶解度变化不大,KNO3随温度升高溶解度变化大,经冷却过滤,故A错误;
B.乙酸乙酯和乙醇混溶,不能用分液的方法分离,应用蒸馏的方法分离,故B正确;
C.小苏打受热分解生成苏打,苏打受热不分解,加热是利用二者的热稳定性不同,故C错误;
D.碘易溶于CCl4,CCl4的沸点比碘低,利用蒸馏的方法分离,不能用升华的方法分离,故D错误.
故选B.
点评 本题考查物质的分离提纯的实验方案的设计,题目难度不大,注意相关物质的性质的异同,把握常见物质的分离方法和操作原理.

练习册系列答案
相关题目
7.胶体区别于其它分散系最本质的特征是( )
| A. | 外观澄清、透明 | B. | 胶体粒子直径在1~100nm之间 | ||
| C. | 能产生丁达尔现象 | D. | 外观澄清、不透明 |
5.一定浓度200mL的HNO3溶液中加入5.6g Fe,全部溶解,得到标准状况下的NO气体2.24L,测得反应后溶液中的c(H+)=0.1mol/L.若反应前后溶液体积变化忽略不计,则下列有关判断正确的是( )
| A. | 反应前HNO3溶液的浓度为2.0mol•L-1 | |
| B. | 反应后溶液中含硝酸亚铁 | |
| C. | 反应后的溶液最多还能溶解3.22g Fe | |
| D. | 反应后溶液中c(NO3-)=1.5mol•L-1 |
12.下列说法不正确的是( )
| A. | 氯气是既不是电解质,也不是非电解质,但其水溶液却可以导电 | |
| B. | Al2O3和MgO都是属于离子化合物,熔沸点都很高,故工业上常用熔点较低的AlCl3和MgCl2来冶炼金属 | |
| C. | H2O是分子晶体,晶体中含氢键,其熔沸点一般比同主族的氢化物要高 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
9.下列除杂的方法正确的是( )
| A. | 除去N2中的少量O2:通过灼热的CuO粉末,收集气体 | |
| B. | 除去CO2中的少量HCl:通入过量NaOH溶液,收集气体 | |
| C. | 除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤 | |
| D. | 除去NaCl溶液中少量CaCl2:加入过量Na2CO3溶液,过滤,滤液中再加入过量盐酸,加热 |
 电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO${\;}_{3}^{-}$含量会增加.
电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO${\;}_{3}^{-}$含量会增加.
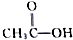 、
、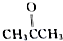 及
及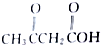 .根据上述事实推测A可能的构造式.
.根据上述事实推测A可能的构造式.