20. 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
已知:
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①请书写A中环己醇制环己烯的化学反应方程式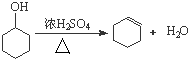 .
.
②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
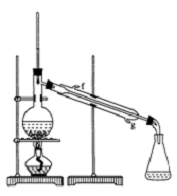
②再将环己烯按右图装置蒸馏,蒸馏时要加入生石灰,目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品B.环己醇实际用量多了C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是B、C.
A.用酸性高锰酸钾溶液B.用金属钠C.测定沸点.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:已知:
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①请书写A中环己醇制环己烯的化学反应方程式
 .
.②A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
③试管C置于冰水浴中的目的是防止环己烯的挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在上 层(填“上”或“下”),分液后用C(填入编号)洗涤.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,蒸馏时要加入生石灰,目的是除去水分.
③收集产品时,控制的温度应在83℃左右,实验制得的环己烯精品质量低于理论产量,可能的原因是C.
A.蒸馏时从70℃开始收集产品B.环己醇实际用量多了C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是B、C.
A.用酸性高锰酸钾溶液B.用金属钠C.测定沸点.
16.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
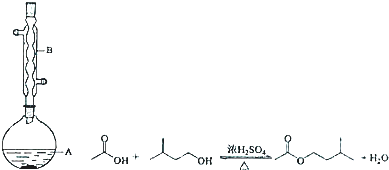
某同学的实验步骤:
①在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸;
②缓慢加热A,回流50min;
③反应液冷至室温后倒入仪器甲中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
④分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体;
⑤进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.
请回答下列问题:
(1)该酯化反应的原子利用率是$\frac{23}{26}$(用分数表示).
(2)实验中仪器B的作用是冷凝回流,步骤③中的仪器甲是分液漏斗.
(3)该同学开始加热A后,发现此前操作中有一处严重的疏漏,如何补救?装置冷却后再补加数片沸石或碎瓷片.
(4)步骤④中加入无水MgSO4是为了除去某种杂质,如何检验该杂质是否除尽?简述实验方法:取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽.
(5)步骤⑤中,若温度计水银球的位置过高,则所收集馏分的沸点高于(填“高于”或“低于”)目标产物的沸点.
(6)本实验的产率是d(填标号). a.30% b.40% c.50% d.60%

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
①在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸;
②缓慢加热A,回流50min;
③反应液冷至室温后倒入仪器甲中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
④分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体;
⑤进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.
请回答下列问题:
(1)该酯化反应的原子利用率是$\frac{23}{26}$(用分数表示).
(2)实验中仪器B的作用是冷凝回流,步骤③中的仪器甲是分液漏斗.
(3)该同学开始加热A后,发现此前操作中有一处严重的疏漏,如何补救?装置冷却后再补加数片沸石或碎瓷片.
(4)步骤④中加入无水MgSO4是为了除去某种杂质,如何检验该杂质是否除尽?简述实验方法:取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽.
(5)步骤⑤中,若温度计水银球的位置过高,则所收集馏分的沸点高于(填“高于”或“低于”)目标产物的沸点.
(6)本实验的产率是d(填标号). a.30% b.40% c.50% d.60%
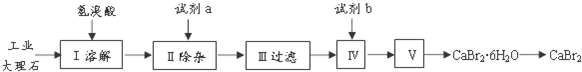
15.溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:

步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)步骤1仪器a中发生的主要反应是 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr
(2)仪器d的作用是吸收HBr防污染防倒吸
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式)
(5)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
0 172436 172444 172450 172454 172460 172462 172466 172472 172474 172480 172486 172490 172492 172496 172502 172504 172510 172514 172516 172520 172522 172526 172528 172530 172531 172532 172534 172535 172536 172538 172540 172544 172546 172550 172552 172556 172562 172564 172570 172574 172576 172580 172586 172592 172594 172600 172604 172606 172612 172616 172622 172630 203614

步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
(1)步骤1仪器a中发生的主要反应是
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr
+HBr(2)仪器d的作用是吸收HBr防污染防倒吸
(3)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率
(4)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2(填化学式)
(5)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
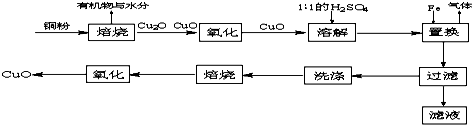
 用如图所示的装置在实验室制取硝基苯.
用如图所示的装置在实验室制取硝基苯.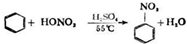 .
. )需使用还原剂.
)需使用还原剂. 实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸.
实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸.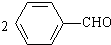 +NaOH→
+NaOH→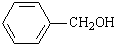 +
+
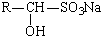 (不容于醚,可溶于水)
(不容于醚,可溶于水)