题目内容
3. 用如图所示的装置在实验室制取硝基苯.
用如图所示的装置在实验室制取硝基苯.(1)在大试管中最先加入的液体物质是BA.碎玻璃片 B.苯 C.硝酸 D.硫酸
发生反应的化学方程式是
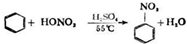 .
.(2)指出图上的两个错误是大试管与烧杯底部接触,烧杯内水偏少.
(3)塞子所带长玻璃管的作用是导气、冷凝回流,使用水浴加热的优点是受热均匀,便于控制反应速率.
(4)充分反应后,将试管中的液体,倒入盛有水的大烧杯中,见有机产物的颜色、气味、状态为淡黄色、苦杏仁味、油状液体.
(5)在思考该实验过程得出的结论错误的是b
a、生成的硝基苯中可能混有二氧化氮
b、需加热条件下进行的该反应一定是吸热反应
c、用硝基苯制取苯胺(
 )需使用还原剂.
)需使用还原剂.
分析 (1)由于苯的密度比较 小,在苯与酸混合过程中要先加入苯,在浓硫酸作催化剂的条件下水浴加热,苯与硝酸发生取代反应生成硝基苯;
(2)根据装置图可知,水浴加热的水的液面低于试管中液体的液面,大试管紧靠烧杯,这样都达不到受热均匀的效果;
(3)浓硝酸和苯都易挥发,为使反应充分进行,要冷凝回流,使用水浴加热受热均匀,便于控制温度;
(4)根据硝基苯的物理性质可知,硝基苯是淡黄色、苦杏仁味、油状液体;
(5)a、浓硝酸易分解,能产生二氧化氮;
b、需加热的反应不一定是吸热反应;
c、将硝基变为氨基,是一个失氧得氢的过程,该过程为还原反应.
解答 解:(1)由于苯的密度比较 小,在苯与酸混合过程中要先加入苯,故选B,在浓硫酸作催化剂的条件下水浴加热,苯与硝酸发生取代反应生成硝基苯,反应方程式为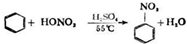 ,
,
故答案为:B;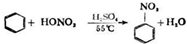 ;
;
(2)根据装置图可知,水浴加热的水的液面低于试管中液体的液面,大试管紧靠烧杯,这样都达不到受热均匀的效果,所以图上的两个错误是大试管与烧杯底部接触、烧杯内水偏少,
故答案为:大试管与烧杯底部接触;烧杯内水偏少;
(3)浓硝酸和苯都易挥发,为使反应充分进行,要冷凝回流,塞子所带长玻璃管的作用是导气、冷凝回流,使用水浴加热受热均匀,便于控制温度,进而控制反应的速率,
故答案为:导气、冷凝回流;受热均匀,便于控制反应速率;
(4)根据硝基苯的物理性质可知,硝基苯是淡黄色、苦杏仁味、油状液体,
故答案为:淡黄色;苦杏仁味;油状液体;
(5)a、浓硝酸易分解,能产生二氧化氮,故a正确;
b、需加热的反应不一定是吸热反应,故b错误;
c、将硝基变为氨基,是一个失氧得氢的过程,该过程为还原反应,故c正确;
故选b.
点评 本题考查硝基苯制备实验的有关判断,该题是基础性试题的考查,试题注重基础,只要是考查学生对硝基苯制备实验的了解掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力.

 阅读快车系列答案
阅读快车系列答案| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 18gD2O和18gH2O中含有的质子数均为10NA |
| A. | Na+、Ba2+、Cl-、NO3- | |
| B. | Pb2+、Hg2+、S2-、SO42- | |
| C. | 0.1mol/L的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| D. | 0.1mol/L Na2CO3的溶液中:K+、Ba2+、NO3-、Cl- |
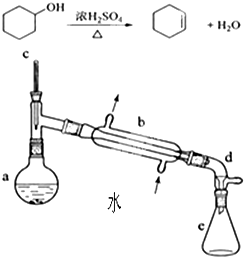 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
1、[合成]:在a中加入适量纯环己醇及2小块沸石,冷却搅动下缓慢加入1 mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的有机副产物的结构简式为
 .
.(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4加入无水CaCl2的作用是干燥所得环己烯.
| A. | NA个氧气分子与NA个氖气分子的质量比是4:5 | |
| B. | 17gOH-与19gH3O+所含质子数相等 | |
| C. | 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等 | |
| D. | 12g C和16g O所含的原子数不相等 |
| A. | 浓硝酸 | B. | 浓硫酸 | C. | 烧碱 | D. | 氢氟酸 |
| A. | 电池一般比较小,即使埋到土壤中也不会造成太大危害 | |
| B. | 电池回收的主要目的是为了提取里面的银、汞等金属 | |
| C. | 废旧电池可以直接通过燃烧的方式销毁 | |
| D. | 电池不仅污染土壤,也污染地下水 |
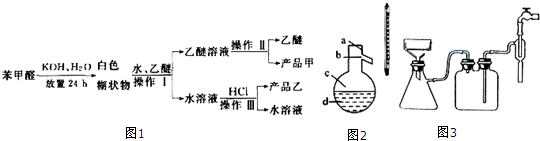
 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题: