��Ŀ����
1����ҵ���Ʊ�BaCl2�Ĺ�������ͼ���£�
ij�о�С����ʵ�������ؾ�ʯ����Ҫ�ɷ�BaSO4���Թ�ҵ���̽���ģ��ʵ�飮�����
BaSO4��s��+4C��s��$\stackrel{����}{?}$4CO��g��+BaS��s����H1=+571.2kJ•mol-1 ��
BaSO4��s��+2C��s��$\stackrel{����}{?}$2CO2��g��+BaS��s����H2=+226.2kJ•mol-1 ��
��1�������ù���NaOH��Һ���գ��õ����ƣ�Na2Sˮ������ӷ���ʽΪS2-+H2O?HS-+OH-��HS-+H2O?H2S+OH-��
��2����BaCl2��Һ�м���AgNO3��KBr�������ֳ�������ʱ��$\frac{c��B{r}^{-}��}{c��Cl-��}$=2.7��10-3��
[Ksp��AgBr��=5.4��10-13��Ksp��AgCl��=2.0��10-10]
��3����ӦC��s��+CO2��g��$\stackrel{����}{?}$2CO��g���ġ�H2=+172.5kJ•mol-1��
��4��ʵ�������б�����������̿��ͬʱ��Ҫͨ���������Ŀ����ʹBaSO4�õ���ֵĻ�ԭ�������BaS�IJ��������٢�Ϊ���ȷ�Ӧ��̿��������Ӧ����ά�ַ�Ӧ������£�
���� ��1��Na2Sˮ��ʼ��ԣ���������ˮ�⣬�Ե�һ��ˮ��Ϊ����
��2�������ܶȻ���������$\frac{c��Br{\;}^{-}��}{c��Cl{\;}^{-}��}$��
��3�����ø�˹���ɼ��㷴Ӧ�ȣ�
��4���������C������ؾ�ʯ��ת���ʣ�ͬʱά�ַ�Ӧ���У�
��� �⣺��1��Na2Sˮ��ʼ��ԣ���������ˮ�⣬�Ե�һ��ˮ��Ϊ������һ��ˮ����������HS-���ڶ���ˮ������H2S��ˮ������ӷ���ʽ�ֱ�ΪS2-+H2O?HS-+OH-��HS-+H2O?H2S+OH-��
�ʴ�Ϊ��S2-+H2O?HS-+OH-��HS-+H2O?H2S+OH-��
��2�������ֳ�������ʱ��Ag+����Ũ����ͬ�������ܶȻ��������㣬c��Br-��=$\frac{K{\;}_{sp}��AgBr��}{c��Ag{\;}^{+}��}$��c��Cl-��=$\frac{K{\;}_{sp}��AgCl��}{c��Ag{\;}^{+}��}$����$\frac{c��Br{\;}^{-}��}{c��Cl{\;}^{-}��}$=$\frac{5.4��1{0}^{-13}}{2.0��1{0}^{-10}}$=2.7��10-3��
�ʴ�Ϊ��2.7��10-3��
��3�����ø�˹������⣺
BaSO4��s��+4C��s��$\frac{\underline{\;����\;}}{\;}$4CO��g��+BaS��s����H1=571.2kJ•mol-1 ��
BaSO4��s��+2C��s��$\frac{\underline{\;����\;}}{\;}$2CO2��g��+BaS��s����H2=226.2kJ•mol-1 ��
�����������Ȼ�ѧ����ʽ�����Ȼ�����2�ɵã�
C��s��+CO2��g��$\frac{\underline{\;����\;}}{\;}$2CO��g����H=$\frac{571.2kJ•mo{l}^{-1}-226.2kJ•mol{\;}^{-1}}{2}$=+172.5kJ•mol-1��
�ʴ�Ϊ��+172.5��
��4���������C������ؾ�ʯ��ת���ʣ����Ϸ�ӦΪ���ȷ�Ӧ��̿��������Ӧ����ά�ַ�Ӧ������£�
�ʴ�Ϊ��ʹBaSO4�õ���ֵĻ�ԭ�������BaS�IJ��������٢�Ϊ���ȷ�Ӧ��̿��������Ӧ����ά�ַ�Ӧ������£�
���� ���⿼���Ϊ�ۺϣ���Ŀ����һ���Ѷȣ��漰�����ˮ�⡢���ܵ���ʵ��ܽ�ƽ�⡢��Ӧ�ȵļ�������⣬����ע���ܶȻ����������ã�

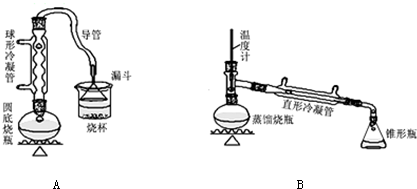
��ش��������⣺
��1��Aװ���У����ձ����Һ�浹��һ��©������Ŀ���Ǽȿ������ճ�֣��ֿ��Է�ֹ������
��2���Ʊ������У������Ũ�������ȱ������ϡ�ͣ���Ŀ����ab��������ĸ��
a�����ٸ�����ϩ���ѵ����� b������Br2������ c��ˮ�Ƿ�Ӧ�Ĵ���
��3����ͬѧ��ͨ����������Ǽ������ò������Ƿ��С�-CH2CH2CH2CH3������ȷ�����������Ƿ���ڶ��ѣ�CH3CH2CH2CH2OCH2CH2CH2CH3���������۸�ͬѧ��Ƶļ��������Ƿ������Ϊʲô���𣺲�����������1-�嶡��Ҳ����-CH2CH2CH2CH3��
��4��Ϊ�˽�һ���ᴿ1-�嶡�飬��С��ͬѧ�������л�����й��������±���
| ���� | �۵�/�� | �е�/�� |
| 1-���� | -89.5 | 117.3 |
| 1-�嶡�� | -112.4 | 101.6 |
| ���� | -95.3 | 142.4 |
| 1-��ϩ | -185.3 | -6.5 |
| ��Է������� | �ܶ�/��g•cm-3�� | �е�/�� | ˮ���ܽ��� | |
| ������ | 88 | 0.8123 | 131 | �� |
| ���� | 60 | 1.0492 | 118 | �� |
| ���������� | 130 | 0.8670 | 142 | ���� |
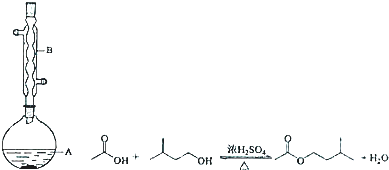
����A�м���4.4g���촼��6.0g���ᡢ����Ũ���
�ڻ�������A������50min��
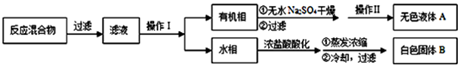
�۷�ӦҺ�������º����������У��ֱ�������ˮ������̼��������Һ��ˮϴ�ӣ�
�ֳܷ��IJ������������ˮMgSO4���壬����Ƭ�̣����˳�ȥMgSO4���壻
�ݽ����������ռ�140��143����֣�������������2.6g��
��ش��������⣺
��1����������Ӧ��ԭ����������$\frac{23}{26}$���÷�����ʾ����
��2��ʵ��������B������������������������е��������Ƿ�Һ©����
��3����ͬѧ��ʼ����A���ִ�ǰ��������һ�����ص���©����β��ȣ�װ����ȴ���ٲ�����Ƭ��ʯ�����Ƭ��
��4��������м�����ˮMgSO4��Ϊ�˳�ȥij�����ʣ���μ���������Ƿ����������ʵ�鷽����ȡ�����ֲ���������м���������ˮ����ͭ����������������ˮ�ѳ�����
��5��������У����¶ȼ�ˮ�����λ�ù��ߣ������ռ���ֵķе���ڣ�����ڡ����ڡ���Ŀ�����ķе㣮
��6����ʵ��IJ�����d�����ţ��� a��30% ��b��40% c��50% d��60%
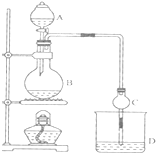 ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A�з���Ũ���ᣬB�з����Ҵ�����ˮ�����ƣ�D�з��б���̼������Һ��
ij����С����Ƶ�ʵ������ȡ����������װ����ͼ��ʾ��A�з���Ũ���ᣬB�з����Ҵ�����ˮ�����ƣ�D�з��б���̼������Һ����֪����ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2•6C2H50H
���й��л���ķе㣺
| �Լ� | ���� | �Ҵ� | ���� | �������� |
| �е�/�� | 34.7 | 78.5 | 118 | 77.1 |
��1��Ũ����������Ǵ�������ˮ�������ú�ͬλ��18O���Ҵ����������ᷴӦ��д���ܱ�ʾ18O λ�õĻ�ѧ����ʽ��CH3COOH+CH3CH218OH$?_{��}^{ŨH_{2}SO_{4}}$CH3CO18OC2H5+H2O��
��2�����θ����C�������Ƿ�ֹ����������������Ӧǰ��D�м��뼸�η�̪����Һ�ʺ�ɫ�������������ԭ���ǣ������ӷ���ʽ��ʾ��CO32-+H2O?HCO3-+OH-����Ӧ������D�е�������Һ�ֲ㣬�ϲ���ɫ����Һ�壬�²���Һ��ɫ��dz��
��3����D�з���������������г�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ�������Ҵ���Ȼ����������ռ�77�����ҵ���֣��Եýϴ���������������
 =2KMnO4$\stackrel{��}{��}$
=2KMnO4$\stackrel{��}{��}$ +KOH+2MnO2��+H2O
+KOH+2MnO2��+H2O +HCl��
+HCl�� +KCl
+KClʵ�鷽����һ�����ļױ���KMnO4��Һ��100�淴Ӧһ��ʱ���ֹͣ��Ӧ�����������̷����������ͻ���δ��Ӧ�ļױ���
��֪����������Էַ�������122���۵�122.4�棬��25���95��ʱ�ܽ�ȶȷֱ�Ϊ0��.3g��6.9g�����������л���һ�㶼�й̶��۵㣮
��1������IΪ��Һ������IIΪ����
��2����ɫҺ��A�Ǽױ����������ֱ���A���Լ����������Ը��������Һ����������ɫ��Һ��ɫ��
��3���ⶨ��ɫ����B���۵㣬��������115�濪ʼ�ۻ����ﵽ130��ʱ�����������ۣ���ͬѧ�Ʋ��ɫ����B�DZ�������KCl�Ļ�����������·��������ᴿ�ͼ��飬ʵ������
���Ʋ���ȷ������ɱ������ݣ�
| ��� | ʵ�鷽�� | �������� | ���� |
| �� | ����ɫ����B����ˮ�У����� �ܽ⣬��ȴ���� | �õ���ɫ�������ɫ��Һ | |
| �� | ȡ������Һ���Թ��У� ���������������ữ��AgNO3��Һ | ���ɰ�ɫ���� | ��Һ��Cl- |
| �� | �����ɫ���壬����ʹ���ۻ��� ����۵� | ����۵�Ϊ122.4�� | ��ɫ�����DZ����� |
| A�� | ��������������ˮ | |
| B�� | �ŵ�Ӱʱ����ӳ���䵽��Ļ�ϵĹ��� | |
| C�� | �Ȼ�����Һ�е�������������Һ���ֺ��ɫ���� | |
| D�� | ����������������γɳ�������ɳ�� |
| A�� | ���������ļ� | B�� | ��������ļ� | ||
| C�� | ����������Ӧ�ļ� | D�� | �缫�������뷴Ӧ�ļ� |