题目内容
4.CuO可用作颜料、玻璃磨光剂、有机合成催化剂等.以下是用含杂质的铜粉氧化法生产CuO的流程图: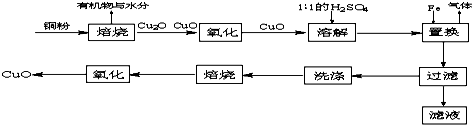
回答下列问题:
(1)写出溶解过程中的离子方程式CuO+2H+=Cu2++H2O.
(2)1:1的H2SO4是用1体积98% H2SO4与1体积水混合而成.配制该硫酸溶液所需的玻璃仪器除玻璃棒外,还需要量筒、烧杯.
(3)该工艺会产生一定量的酸性气体,该气体是SO2(写分子式),应加以回收处理.
(4)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成.假设焙烧后固体只含铜的氧化物,为检验该固体的成分,下列实验设计合理的是bc(选填序号).
(a)加入稀H2SO4,若溶液呈现蓝色,说明固体中一定有CuO
(b)加入稀H2SO4,若有红色沉淀物,说明固体中一定有Cu2O
(c)加入稀HNO3,若有无色气体(随即变成红棕色)产生,说明固体中有Cu2O
(d)加入稀HNO3,若全部溶解,说明固体中没有Cu2O.
分析 铜粉焙烧生成Cu2O、CuO和有机物、水,Cu2O被氧化生成CuO,CuO和稀硫酸反应生成CuSO4,溶液中还存在硫酸,硫酸、CuSO4和Fe发生置换反应生成FeSO4,过滤得沉淀Cu,然后洗涤、焙烧、氧化得到CuO,
(1)CuO和稀硫酸反应生成硫酸铜和水;
(2)根据仪器的作用选取仪器;
(3)金属和浓硫酸反应生成二氧化硫;
(4)氧化亚铜和稀硫酸反应生成硫酸铜和铜单质,如果将固体加入稀硫酸中有红色物质生成,就说明含有氧化亚铜,氧化亚铜能还原硝酸生成一氧化氮,一氧化氮遇空气变为红棕色的二氧化氮,据此选择;
解答 解:铜粉焙烧生成Cu2O、CuO和有机物、水,Cu2O被氧化生成CuO,CuO和稀硫酸反应生成CuSO4,溶液中还存在硫酸,硫酸、CuSO4和Fe发生置换反应生成FeSO4,过滤得沉淀Cu,然后洗涤、焙烧、氧化得到CuO,
(1)CuO和稀硫酸反应生成硫酸铜和水,离子方程式为:CuO+2H+=Cu2++H2O,
故答案为:CuO+2H+=Cu2++H2O;
(2)配制硫酸时,需要烧杯盛放硫酸溶液,需要量筒量取浓硫酸,所以还需要烧杯、量筒,
故答案为:量筒、烧杯;
(3)浓硫酸和金属反应生成SO2,SO2属于酸性氧化物,能和水反应生成亚硫酸,且SO2有毒,不能直接排空,所以SO2要收集处理,
故答案为:SO2;
(4)氧化亚铜和稀硫酸反应生成CuSO4和Cu,将固体加入稀硫酸中,如果有红色物质生成,就说明含有氧化亚铜,否则没有氧化亚铜,其检验方法为:取少许样品,加入稀H2SO4,若溶液中存在红色固体,说明含有Cu2O,反之则没有,氧化亚铜能还原硝酸生成一氧化氮,一氧化氮遇空气变为红棕色的二氧化氮,如果出现无色气体(随即变成红棕色)产生,也可说明含有Cu2O,Cu2O、CuO都能溶于硫酸产生蓝色溶液,也都溶于硝酸,故选bc.
点评 本题以铜为载体考查了物质的分离和提纯,涉及物质的检验、仪器的选取、物质间的反应等知识点,明确原理是解本题关键,要从整体上分析工艺流程,知道每一步发生的反应、物质分离的方法等,题目难度中等.

| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+2ClO-=SO42-+Cl-+HClO | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
| A. | Cl2+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuCl2 | |
| B. | SO2+2H2S═3S↓+2H2O | |
| C. | 8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2 | |
| D. | NH3+HNO3═NH4NO3 |

Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.
(1)甲同学设计实验所涉及的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为2Br-+Cl2?Br2+2Cl-.
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到溶液由橙黄色变为蓝色;
(3)根据甲乙同学的实验可得到的结论是:同一主族元素,从上到下,元素的非金属性减弱.
Ⅱ.
| 实验目的 | 探究温度对双氧水分解反应的速率的影响 | ||
| 实验 | 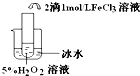 | 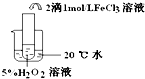 | 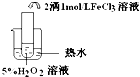 |
| 实验结论 | 结论:温度越高,反应速率越快 FeCl3在实验中的作用为:催化剂 | ||
| 反应方程式 | 2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑ | ||
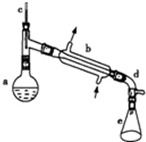 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如下,
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应如下, $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ ,实验装置如图所示.可能用到的有关数据如表:
,实验装置如图所示.可能用到的有关数据如表:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:将馏出物倒入分液漏斗中依次用少量5%碳酸钠溶液和蒸馏水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是冷凝管.
(2)加入碎瓷片的作用是防暴沸,如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是B(填正确答案标号)
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的有机副产物为
 .
.(4)在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是吸收产物中少量的水.
(6)本实验所得到的环己烯产率是61%.
| A. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| B. | Ba(NO3)2可溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| C. | 试管内壁残留的硫酸铁溶液与氢氧化钠溶液反应后产生红褐色固体,可以用盐酸将其溶解. | |
| D. | 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ |
①氢气、金属钠和红磷都能在氯气中燃烧生成白色的烟雾
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③氯气与水的反应中氯是氧化剂,水是还原剂
④氯气通入AgNO3溶液中产生白色沉淀.
| A. | ①、②、③ | B. | ①、③、④ | C. | ①、②、④ | D. | ②、③、④ |
| A. | 锌能提高脑神经的兴奋性 | B. | 钙能促进骨骼的生长发育 | ||
| C. | 缺氟能使人甲状腺肿大 | D. | 缺铁能使人贫血 |
