题目内容
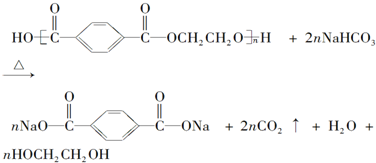
16.乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味.实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下: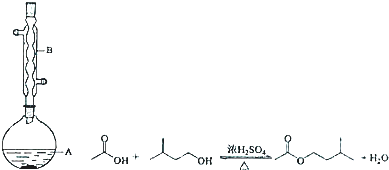
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
①在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸;
②缓慢加热A,回流50min;
③反应液冷至室温后倒入仪器甲中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;
④分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体;
⑤进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯2.6g.
请回答下列问题:
(1)该酯化反应的原子利用率是$\frac{23}{26}$(用分数表示).
(2)实验中仪器B的作用是冷凝回流,步骤③中的仪器甲是分液漏斗.
(3)该同学开始加热A后,发现此前操作中有一处严重的疏漏,如何补救?装置冷却后再补加数片沸石或碎瓷片.
(4)步骤④中加入无水MgSO4是为了除去某种杂质,如何检验该杂质是否除尽?简述实验方法:取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽.
(5)步骤⑤中,若温度计水银球的位置过高,则所收集馏分的沸点高于(填“高于”或“低于”)目标产物的沸点.
(6)本实验的产率是d(填标号). a.30% b.40% c.50% d.60%
分析 (1)根据反应前后有机物中原子数目可判断酯化反应的原子利用率;
(2)异戊醇、乙酸都是易挥发的物质,为使反应能充分进行,要用冷凝管冷凝回流,乙酸异戊酯难溶于水,根据分离两种互不相溶的液体的方法答题;
(3)根据实验步骤可知,该同学开始加热A前没加沸石,所以加热后要再加沸石,要等溶液冷却后再补加,据此答题;
(4)步骤④中加入无水MgSO4是为了除去产品中的水份,可以用无水硫酸铜检验产品中是否有水;
(5)步骤⑤中,若温度计水银球的位置过高,则从支管处出来的气体的沸点高于目标产物;
(6)先计算出乙酸和异戊醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成乙酸异戊酯的物质的量,最后根据实际上制取的乙酸异戊酯计算出产率.
解答 解:(1)根据反应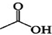 +
+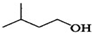 $?_{△}^{浓H_{2}SO_{4}}$
$?_{△}^{浓H_{2}SO_{4}}$ +H2O前后有机物中原子数目之比为$\frac{23}{26}$,所以该酯化反应的原子利用率为$\frac{23}{26}$,
+H2O前后有机物中原子数目之比为$\frac{23}{26}$,所以该酯化反应的原子利用率为$\frac{23}{26}$,
故答案为:$\frac{23}{26}$;
(2)异戊醇、乙酸都是易挥发的物质,为使反应能充分进行,要用冷凝管冷凝回流,乙酸异戊酯难溶于水,分离两种互不相溶的液体通常用分液漏斗,
故答案为:冷凝回流;分液漏斗;
(3)根据实验步骤可知,该同学开始加热A前没加沸石,所以加热后要再加沸石,要等溶液冷却后再补加,
故答案为:装置冷却后再补加数片沸石或碎瓷片;
(4)步骤④中加入无水MgSO4是为了除去产品中的水份,可以用无水硫酸铜检验产品中是否有水,具体操作为取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽,
故答案为:取出部分产物,往其中中加入少量无水硫酸铜,若不变蓝,表明水已除尽;
(5)步骤⑤中,若温度计水银球的位置过高,则从支管处出来的气体的沸点高于目标产物,
故答案为:高于;
(6)乙酸的物质的量为:n=$\frac{6.0g}{60g/mol}$=0.1mol,异戊醇的物质的量为:n=$\frac{4.4g}{88g/mol}$=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为:$\frac{3.9g}{130g/mol}$=0.03mol,所以实验中乙酸异戊酯的产率为:$\frac{0.03mol}{0.05mol}$×100%=60%,
故选d.
点评 本题考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、药品的选择及使用、物质产率的计算等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.

(1)烧杯中未溶物可能仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成.设计实验方案,进行成分检
验.写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于试管中,取适量步骤1中的沉淀于试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中. | |
| 步骤4:取适量滤液于烧杯中,用pH计测其 pH值 |
①配制250mL约0.1mol•L-1 Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解,将溶液转入250ml的容量瓶中,洗涤,定容,摇匀.
②滴定:准确量取25.00mL所配Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980(填“0.0210”、“0.0536”、“0.1980”或“1.5000”)mol•L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸V mL.
③计算Ba(OH)2•8H2O的质量分数=$\frac{0.25L×\frac{0.198V}{50}mol×315g/mol}{wg}$×100%(只列出算式,不做运算).
(4)室温下,不能(填“能”或“不能”) 配制1.0 mol•L-1 Ba(OH)2溶液.
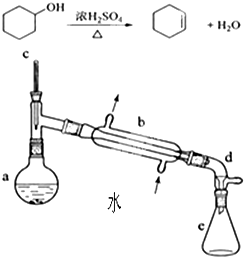 实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:
实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:相关数据如下:| 相对分子质量 | 密度/(g•cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
1、[合成]:在a中加入适量纯环己醇及2小块沸石,冷却搅动下缓慢加入1 mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
2、[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得纯环己烯.
回答下列问题:
(1)装置b的名称是冷凝管.加入沸石的目的是防暴沸.
(2)本实验中最容易产生的有机副产物的结构简式为
 .
.(3)分液漏斗在使用前必须清洗干净并检漏.本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(4)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4加入无水CaCl2的作用是干燥所得环己烯.
| A. | 平衡时,v正(O2)=v逆(NO)必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO | |
| D. | 用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最大 |

 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题: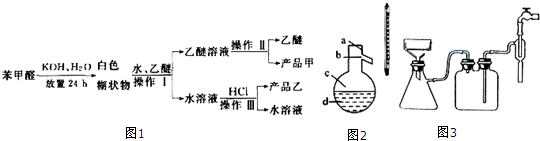

 ,B的原子结构示意图为
,B的原子结构示意图为 .
.