11.对H2O的电离平衡不产生影响的粒子是( )
| A. | HCl | B. | Na | C. | Na2SO4 | D. | NaHSO4 |
9. 某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
请回答下列问题:
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)2Fe(NO3)3+Fe═3Fe(NO3)2.
(2)实验Ⅰ中,发生反应的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+:Fe2++NO?[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是Fe2+被稀硝酸氧化为Fe3+,使溶液中c(Fe2+)逐渐下降(同时NO的逐渐逸出,也使溶液中c(NO)逐渐下降),平衡Fe2++NO?[Fe(NO)]2+左移,溶液棕色褪去,显示出Fe3+的黄色..
(4)分析实验现象,同学们得出了结论.则:
①实验Ⅳ的后续操作是加入K3[Fe(CN)6]溶液,观察到的现象是生成蓝色沉淀.
②由实验得出的结论是氧化性:NO3->Fe3+>SO42-.
(5)实验反思
①实验操作V的目的是将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收,防止污染大气.
②实验操作Ⅲ,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+.
③有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气.你是否同意该看法,理由是不同意,
a.实验Ⅰ中溶液变棕色,有NO生成,说明硝酸氧化Fe2+:氧化性NO3->Fe3+;
b.实验Ⅳ中溶液中检出Fe2+,说明二氧化硫还原了Fe3+:氧化性Fe3+>SO42-;
与装置中是否有氧气无关..
 某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色. |
| Ⅱ | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
| Ⅲ | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成. |
| Ⅳ | 一段时间后,用注射器取出少量B装置中的溶液,… | … |
| Ⅴ | 打开活塞a,通入一段时间空气 | ---- |
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)2Fe(NO3)3+Fe═3Fe(NO3)2.
(2)实验Ⅰ中,发生反应的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+:Fe2++NO?[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是Fe2+被稀硝酸氧化为Fe3+,使溶液中c(Fe2+)逐渐下降(同时NO的逐渐逸出,也使溶液中c(NO)逐渐下降),平衡Fe2++NO?[Fe(NO)]2+左移,溶液棕色褪去,显示出Fe3+的黄色..
(4)分析实验现象,同学们得出了结论.则:
①实验Ⅳ的后续操作是加入K3[Fe(CN)6]溶液,观察到的现象是生成蓝色沉淀.
②由实验得出的结论是氧化性:NO3->Fe3+>SO42-.
(5)实验反思
①实验操作V的目的是将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收,防止污染大气.
②实验操作Ⅲ,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+.
③有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气.你是否同意该看法,理由是不同意,
a.实验Ⅰ中溶液变棕色,有NO生成,说明硝酸氧化Fe2+:氧化性NO3->Fe3+;
b.实验Ⅳ中溶液中检出Fe2+,说明二氧化硫还原了Fe3+:氧化性Fe3+>SO42-;
与装置中是否有氧气无关..
8.肼(N2H4)是一种重要的工业产品.资料表明,氨和次氯酸钠溶液反应能生成肼.相关物质的物理性质如下:
某学生对NH3与NaClO的反应进行实验探究:
(1)NaClO溶液呈碱性的原因是(用离子方程式表示)ClO-+H2O?HClO+OH-.
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则沉淀洗涤干净.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
(5)常见无机酸与N2H4反应的能力顺序如下:H3PO4<H2SO4<HClO4.原因是P、S、Cl都是第三周期元素.同一周期的元素,从左到右,核电荷数逐渐增大,原子半径减小,得电子能力逐渐增强,元素的非金属性逐渐增强,非金属最高价含氧酸与N2H4的反应能力逐渐增强.
| 性状 | 熔点/℃ | 沸点/℃ | 水溶性 | |
| N2H4 | 无色液体 | 1.4 | 113 | 与水混溶 |
| N2H6SO4 | 无色晶体 | 254 | / | 微溶于冷水,易溶于热水 |
| 步骤 | 操作 | 现象 |
| I | 取10g NaClO固体,加入100mL水 | 固体溶解,溶液呈碱性 |
| II |  | 液面上方出现白雾 |
(2)肼是一种二元弱碱.
①向肼的溶液中滴加石蕊试剂,溶液变蓝,其原因是(用化学用语表示)N2H4+H2O?N2H5++OH-.
②向水中持续通入NH3,未观察到白雾.推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝.该实验不能判断白雾中含有N2H4,理由是白雾中混有NH3,NH3也可以使湿润的红色石蕊试纸变蓝.
(3)进一步实验确认了A中生成了N2H4.步骤II中反应的化学方程式是(N2不参与反应)2NH3+NaClO═N2H4+NaCl+H2O.
(4)继续进行如下实验:
a.向A中加入过量稀硫酸,得到沉淀.过滤、洗涤,得到N2H6SO4固体.
b.将N2H6SO4固体溶于KOH溶液,蒸馏,得到高纯度、高浓度的N2H4溶液.
①通过检验Cl-来判断沉淀是否洗涤干净.检验Cl-操作是取少量洗涤后的滤液放入试管中,加入足量Ba(NO3)2溶液振荡,静置后,在上层清液中继续加入硝酸酸化的AgNO3溶液,若无白色沉淀产生,则沉淀洗涤干净.
②提纯含有NaCl的N2H6SO4固体的实验方法可以是重结晶.
③实验b中省略的实验操作是蒸馏.
(5)常见无机酸与N2H4反应的能力顺序如下:H3PO4<H2SO4<HClO4.原因是P、S、Cl都是第三周期元素.同一周期的元素,从左到右,核电荷数逐渐增大,原子半径减小,得电子能力逐渐增强,元素的非金属性逐渐增强,非金属最高价含氧酸与N2H4的反应能力逐渐增强.
7.以碳化硅、氮化镓(GaN)等为代表的第三代半导体材料具有高发光效率、抗腐蚀、化学稳定性好、高强度等特性,是目前最先进的半导体材料.
(1)上述各种元素中,原子半径最小的元素原子的结构示意图是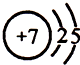 .
.
(2)碳化硅中的化学键类型是极性共价键.
(3)下列反应(或反应组)能说明碳的非金属性强于硅的是ac(选填编号).
a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑
c.SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2
(4)镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
①氢氧化镓的电离方程式是Ga3++3OH-?Ga(OH)3?GaO2-+H++H2O.
②镓与烧碱溶液反应的离子方程式是2Ga+2OH-+2H2O═2GaO2-+3H2↑.
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(5)氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中.该反应的化学方程式是GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
(1)上述各种元素中,原子半径最小的元素原子的结构示意图是
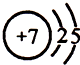 .
.(2)碳化硅中的化学键类型是极性共价键.
(3)下列反应(或反应组)能说明碳的非金属性强于硅的是ac(选填编号).
a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑
c.SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2
(4)镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
②镓与烧碱溶液反应的离子方程式是2Ga+2OH-+2H2O═2GaO2-+3H2↑.
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(5)氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中.该反应的化学方程式是GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
6.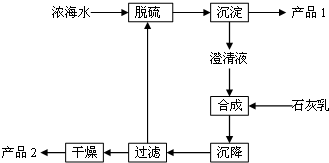 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是 .
.
②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
①脱硫阶段主要反应的离子方程式为Ca2++SO42-═CaSO4↓;
②产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是
 .
.②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
5.200mL硝酸与一定量的铝镁铁合金反应生成3.36L NO(标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入150mL 3mol•L-1的NaOH溶液,使铝镁铁元素恰好全部转化为沉淀,则原硝酸的浓度是( )
| A. | 1.5 mol•L-1 | B. | 2.25 mol•L-1 | C. | 3 mol•L-1 | D. | 无法计算 |
4.下列各项中,由实验事实能得出相应结论的是( )
| 选项 | 理由 | 结论 |
| A | 相同物质的量浓度溶液的pH: Ca(ClO)2>CH3COONa | 酸性:CH3COOH>HClO |
| B | 同体积相同pH的盐酸和醋酸与相同的锌 反应的速率:醋酸>盐酸 | 酸性:HCl>CH3COOH |
| C | 相同条件下的沸点: H2O>NH3 | 非金属性:O>N |
| D | 相同物质的量得到电子的数目: 稀硝酸>浓硝酸 | 氧化性:稀硝酸>浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
3.下列离子方程式书写正确的是( )
| A. | Ca(ClO)2溶液中通入过量的二氧化硫气体:ClO-+SO2+H2O═HClO+HSO3- | |
| B. | 向Ba(NO3)2溶液中通入过量SO2:3Ba2++3SO2+2NO3-+2H2O═2NO↑+3BaSO4↓+4H+ | |
| C. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
2.下列说法正确的是( )
0 172232 172240 172246 172250 172256 172258 172262 172268 172270 172276 172282 172286 172288 172292 172298 172300 172306 172310 172312 172316 172318 172322 172324 172326 172327 172328 172330 172331 172332 172334 172336 172340 172342 172346 172348 172352 172358 172360 172366 172370 172372 172376 172382 172388 172390 172396 172400 172402 172408 172412 172418 172426 203614
| A. | 常温下锌与浓硫酸不反应,与稀硫酸反应生成氢气 | |
| B. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| C. | 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 | |
| D. | FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液变成血红色 |
 ,其合成路线如图所示:
,其合成路线如图所示: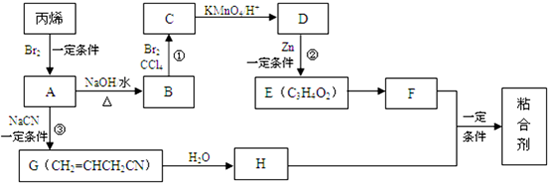
 .
. .
. .
.