题目内容
7.以碳化硅、氮化镓(GaN)等为代表的第三代半导体材料具有高发光效率、抗腐蚀、化学稳定性好、高强度等特性,是目前最先进的半导体材料.(1)上述各种元素中,原子半径最小的元素原子的结构示意图是
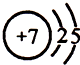 .
.(2)碳化硅中的化学键类型是极性共价键.
(3)下列反应(或反应组)能说明碳的非金属性强于硅的是ac(选填编号).
a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑
c.SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2
(4)镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:
| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
②镓与烧碱溶液反应的离子方程式是2Ga+2OH-+2H2O═2GaO2-+3H2↑.
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
(5)氮化镓(GaN)性质稳定,但能缓慢的溶解在热的NaOH溶液中.该反应的化学方程式是GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
分析 (1)电子层数越多,原子半径越大,电子层数相同时,原子序数越大,原子半径越小;
(2)不同非金属原子间形成极性共价键;
(3)根据单质之间的置换反应、气态氢化物的稳定性、最高价含氧酸的酸性、与氢化合的难易、元素周期律等来比较非金属性,以此来解答;
(4)①氢氧化镓与氢氧化铝的性质相似,结合氢氧化铝的电离书写;
②镓与烧碱溶液反应生成GaO2-和H2;
③所得的溶液中存在平衡:H++H2O+GaO2-?Ga(OH)3,H++H2O+AlO2-?Al(OH)3,电离平衡常数越小,越容易析出得到沉淀;
(5)氮化镓与氢氧化钠溶液反应生成氨气和NaGaO2.
解答 解:(1)电子层数越多,原子半径越大,电子层数相同时,原子序数越大,原子半径越小,则原子半径最小的是N,其原子的结构示意图是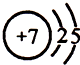 ;
;
故答案为: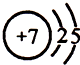 ;
;
(2)不同非金属原子间形成极性共价键,则碳化硅中的化学键类型是极性共价键;
故答案为:极性共价键;
(3)a.SiO32-+2CO2+2H2O→H2SiO3+2HCO3-,说明碳酸的酸性大于硅酸的酸性,则能说明碳的非金属性强于硅,故正确;
b.SiO2+2C$\stackrel{高温}{→}$Si+2CO↑,该反应是在高温条件下的反应,不能说明C的非金属性强于硅,故错误;
c.氢化物越稳定,其非金属性越强,SiH4$\stackrel{500℃}{→}$Si+2H2; CH4$\stackrel{>100℃}{→}$C+2H2,则能说明碳的非金属性强于硅,故正确;
d.Si+O2$\stackrel{900℃}{→}$SiO2; C+O2$\stackrel{300℃}{→}$CO2,不能说明C的非金属性强于硅,故错误;
故答案为:ac;
(4)①氢氧化镓与氢氧化铝的性质相似,存在酸式电离和碱式电离,氢氧化镓的电离方程式为:Ga3++3OH-?Ga(OH)3?GaO2-+H++H2O,
故答案为:Ga3++3OH-?Ga(OH)3?GaO2-+H++H2O;
②镓与烧碱溶液反应生成GaO2-和H2,其反应的离子方程式为:2Ga+2OH-+2H2O═2GaO2-+3H2↑;
故答案为:2Ga+2OH-+2H2O═2GaO2-+3H2↑;
③所得的溶液中存在平衡:H++H2O+GaO2-?Ga(OH)3,H++H2O+AlO2-?Al(OH)3,Al(OH)3的电离平衡常数更小,故溶液中通入二氧化碳,先析出Al(OH)3沉淀,
故答案为:Al(OH)3.
(5)氮化镓与氢氧化钠溶液反应生成氨气和NaGaO2,其反应的方程式为:GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑;
故答案为:GaN+NaOH+H2O$\frac{\underline{\;\;△\;\;}}{\;}$NaGaO2+NH3↑.
点评 本题考查结构性质位置关系应用、常用化学用语、电离平衡常数应用,难度中等,(4)中注意根据氢氧化铝性质进行解答,考查了学生对基础知识的综合应用能力.

 阅读快车系列答案
阅读快车系列答案 S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.
S2Cl2是工业上常用的硫化剂,可以改变生橡胶受热发粘、遇冷变硬的性质.| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
实验室制备S2Cl2的反应原理有两种:
①CS2+3C12$\frac{\underline{\;95~100℃\;}}{\;}$ CC14+S2Cl2;
②2S+Cl2$\frac{\underline{\;111~140℃\;}}{\;}$ S2Cl2.
(1)若实验室选择图装置(部分夹持装置已略去)来制备S2Cl2,其反应原理是上述中的①(填写序号);图中尾气处理装置不够完善,改进后的装置应起到的作用是:在D和E之间增加装置以起到干燥、尾气吸收、防倒吸的作用.利用改进后的正确装置进行实验,请回答以下问题:
(2)为了提高产品S2Cl2的纯度,实验操作的关键是控制好温度和控制浓盐酸的滴速不要太快.
(3)该实验的操作顺序为:①③②⑤④(用序号表示).
①点燃酒精灯A ②点燃酒精灯D ③通冷凝水 ④熄灭酒精灯A ⑤熄灭酒精灯D
(4)某同学取少量产物,小心加入适量水中,观察到有白雾、黄色沉淀且产生的无色气体能使品红溶液褪色,该同学据此判断上述实验确有S2Cl2生成.写出S2Cl2与水反应的化学方程式:2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
(5)S2Cl2中每个原子的最外层都具有8电子结构,请用电子式表示S2Cl2的形成过程:
 .
. | A. | 由不同元素组成的共价化合物中一定只存在极性键 | |
| B. | 多电子原子中,在离核较远的区域内运动的电子能量较低 | |
| C. | 科学家在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 决定化学反应是吸收能量还是放出能量的是反应物总能量的多少 |
| A. | 常温下锌与浓硫酸不反应,与稀硫酸反应生成氢气 | |
| B. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| C. | 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色 | |
| D. | FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体剩余,加入KCSN溶液变成血红色 |
| A. | NaAlO2溶液中滴加NaHCO3溶液:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2HI+SO42-+2H+ | |
| C. | FeSO4溶液中滴加双氧水:2Fe2++2H2O2═2Fe3++O2↑+2H2O | |
| D. | 向Ca(ClO)2溶液中通入足量SO2:ClO-+H2O+SO2═HClO+HSO3- |
| A. | 16gO2中含有NA个氧原子 | |
| B. | 标准状况下,22.4L空气中含有NA个单质原子 | |
| C. | 分子数为NA的CO、N2混合气体的体积约为22.4L,质量为28g | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol |