题目内容
5.200mL硝酸与一定量的铝镁铁合金反应生成3.36L NO(标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入150mL 3mol•L-1的NaOH溶液,使铝镁铁元素恰好全部转化为沉淀,则原硝酸的浓度是( )| A. | 1.5 mol•L-1 | B. | 2.25 mol•L-1 | C. | 3 mol•L-1 | D. | 无法计算 |
分析 硝酸和金属反应生成硝酸盐和NO,硝酸盐和NaOH完全反应生成氢氧化物沉淀,硝酸根离子和氢氧根离子都带一个单位负电荷,则生成氢氧化物、硝酸盐消耗的n(OH-)=n(NO3-),再根据N原子守恒计算硝酸浓度.
解答 解:硝酸和金属反应生成硝酸盐和NO,硝酸盐和NaOH完全反应生成氢氧化物沉淀,硝酸根离子和氢氧根离子都带一个单位负电荷,则生成氢氧化物、硝酸盐消耗的n(OH-)=n(NO3-)=3mol/L×0.15L=0.45mol,原来溶液中n(HNO3)=n(NO3-)+n(NO)=0.45mol+$\frac{3.36L}{22.4L/mol}$=0.6mol,则原来硝酸浓度=$\frac{0.6mol}{0.2L}$=3mol/L,
故选C.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,如果采用常规方法进行计算较麻烦且反应方程式较多,如果采用等量代换能化繁为简,明确硝酸盐中硝酸根离子与氢氧根离子物质的量关系是解本题关键,题目难度中等.

练习册系列答案
相关题目
15.高温焙烧含硫废渣会产生SO2废气,为了回收利用SO2,研究人员研制了利用低品位软锰矿浆(主要成分是MnO2)吸收SO2,并制备硫酸锰晶体的生产流程,其流程示意图如下:

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
请回答下列问题:
(1)高温焙烧:在实验室宜选择的主要仪器是坩埚.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并调节溶液pH,pH应调节的范围是4.7≤pH<8.3.
(4)滤渣的主要成分有硫酸钙、氢氧化铁、氢氧化铝.
(5)工业生产中为了确定需要向浸出液中加入多少MnO2粉,可准确量取10.00mL浸出液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是当滴入最后一滴酸性KMnO4溶液,溶液变紫红色,且半分钟内不褪色.若达滴定终点共消耗10.00mL酸性KMnO4溶液,请计算浸出液中Fe2+浓度是0.1mol/L.

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)高温焙烧:在实验室宜选择的主要仪器是坩埚.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并调节溶液pH,pH应调节的范围是4.7≤pH<8.3.
(4)滤渣的主要成分有硫酸钙、氢氧化铁、氢氧化铝.
(5)工业生产中为了确定需要向浸出液中加入多少MnO2粉,可准确量取10.00mL浸出液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是当滴入最后一滴酸性KMnO4溶液,溶液变紫红色,且半分钟内不褪色.若达滴定终点共消耗10.00mL酸性KMnO4溶液,请计算浸出液中Fe2+浓度是0.1mol/L.
13.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 中子数为1的氢原子:${\;}_{1}^{1}$H | ||
| C. | 甲基的电子式: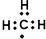 | D. | CO2的比例模型: |
20.关于下列各实验装置图的叙述中,正确的是( )

| A. | 装置①可用于分离碘和氯化钠的固体混合物 | |
| B. | 装置②可用于吸收HCl或NH3气体 | |
| C. | 装置③可用于分解NH4HCO3制备NH3 | |
| D. | 装置④b口进气可收集CO2或NO气体 |
17.某实验小组用0.50mol/LNaOH溶液和0.50mol/L溶液进行中和热的测定.通过测定反应过程中所放出的热量可计算中和反应热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和反应热数值偏小(填“偏大”、“偏小”、“无影响”).
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会偏小(填“偏大”、“偏小”或“无影响”);
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写下表
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和反应热数值偏小(填“偏大”、“偏小”、“无影响”).
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会偏小(填“偏大”、“偏小”或“无影响”);
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表.
实验次数[来源:Zxxk.Com] 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
15.已知Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,则下列关于该反应的叙述不正确的是( )
| A. | 该反应中旧键断裂需吸收能量小于新键形成需放出能量 | |
| B. | 上述热化学方程式中的△H的值与反应物的用量无关 | |
| C. | 该反应的化学能可以转化为电能 | |
| D. | 反应物的总能量高于生成物的总能量 |

 ,其合成路线如图所示:
,其合成路线如图所示: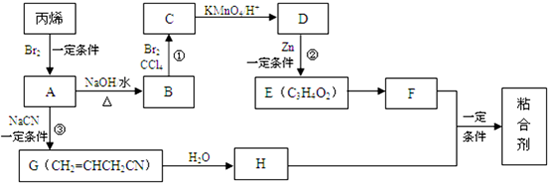
 .
. .
. .
.