11.盛有氯化钡稀溶液的甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量氯水,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( )
| A. | 甲、乙两试管都有白色沉淀生成 | B. | 甲、乙两管都没有白色沉淀生成 | ||
| C. | 甲管没有白色沉淀生成而乙试管有 | D. | 甲管有白色沉淀而乙试管没有 |
10.NA为阿伏伽德罗常数,下列叙述错误的是( )
| A. | 17gNH3中含有的质子数为10NA | |
| B. | 12g金刚石中含有的共价键数为4 NA | |
| C. | 46gNO2和N2O4混合气体中含有的原子总数为3 NA | |
| D. | 1molNa与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
9.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 现有元素周期表包括18个纵列,共16个族 |
8.鉴别NO2和溴蒸气的方法不正确的是( )
| A. | 用四氯化碳溶液 | B. | 用湿润的淀粉碘化钾试纸 | ||
| C. | 用硝酸银溶液 | D. | 用蒸馏水 |
7.下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧.
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧.
| A. | ①②③ | B. | ①③⑤ | C. | ①②⑤ | D. | ②③④ |
6.常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{{c(O{H^-})}}{{c({H^+})}}$=1×10-6,下列叙述正确的是( )
| A. | 加水稀释,溶液的c(OH-)增大 | |
| B. | 此时,HA的电离平衡常数约为10-8 | |
| C. | 溶液中水电离出的H+的物质的量浓度约为10-10mol•L-1 | |
| D. | 与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+) |
5.已知723K时,2SO2(g)+O2(g)?2SO3(g)△H=-Q,在相同条件下,向一密闭容器中通入2mol SO2和1mol O2,达到平衡时放出的热量为Q1;向另一体积相同的密闭容器中通入1mol SO2和0.5mol O2,达到平衡时放出的热量为Q2.则Q1、Q2、Q满足的关系是( )

| A. | Q=2Q2 | B. | Q1=2Q2 | C. | Q=Q1>Q2 | D. | Q>Q1>Q2 |
4.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是( )
| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
3.对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )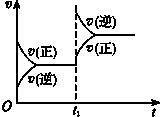

| A. | A、B都是气体,C、D都不是气体 | B. | A、B都是气体,C、D有一种是气体 | ||
| C. | C、D都是气体,A、B都是气体 | D. | C、D都是气体,A、B有一种是气体 |
2.0.1mol•L-1的下列物质的水溶液中,氢离子浓度最大的是( )
0 171068 171076 171082 171086 171092 171094 171098 171104 171106 171112 171118 171122 171124 171128 171134 171136 171142 171146 171148 171152 171154 171158 171160 171162 171163 171164 171166 171167 171168 171170 171172 171176 171178 171182 171184 171188 171194 171196 171202 171206 171208 171212 171218 171224 171226 171232 171236 171238 171244 171248 171254 171262 203614
| A. | NH3•H2O | B. | NH4Cl | C. | HCl | D. | HCOOH |