题目内容
8.鉴别NO2和溴蒸气的方法不正确的是( )| A. | 用四氯化碳溶液 | B. | 用湿润的淀粉碘化钾试纸 | ||
| C. | 用硝酸银溶液 | D. | 用蒸馏水 |
分析 二氧化氮和水反应生成硝酸和NO,而溴可溶于水,溴水呈橙黄色,可与硝酸银溶液反应生成浅黄色沉淀;二者都具有强氧化性,二者均与碱反应生成无色溶液,以此解答.
解答 解:A.溴蒸气易溶于四氯化碳,而二氧化氮不能,现象不同,可鉴别,故A正确;
B.NO2和Br2蒸气均能氧化KI中的碘离子生成碘单质,遇淀粉变蓝,现象相同,不能鉴别,故B错误;
C.二氧化氮通入到硝酸银溶液,有气体生成,而溴蒸气通入到硝酸银溶液中生成AgBr浅黄色沉淀,现象不同,能鉴别,故C正确;
D.NO2和水反应后,溶液为无色,而Br2蒸气与水反应,且溴水为橙色,现象不相同,能鉴别,故D正确;
故选B.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质、性质差异为解答的关键,侧重分析与实验能力的考查,注意判断发生的氧化还原反应,题目难度不大.

练习册系列答案
相关题目
18.今有室温下四种溶液,有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 11 | 11 | 3 | 3 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | ③、④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | ②、③两溶液等体积混合,所得溶液中c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 分别加水稀释10倍,四种溶液的pH ①>②>④>③ | |
| D. | VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9 |
19.下列物质性质的变化规律,与共价键的键能大小有关的是( )
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| C. | Na、Mg、Al的还原性依次减弱 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
16.下列说法错误的是( )
| A. | Na2SO3溶液与BaCl2溶液作用,有白色沉淀生成,加盐酸后沉淀消失 | |
| B. | 将SO2气体通入过量Ba(OH)2溶液中,有白色沉淀生成 | |
| C. | 将NO2气体通入KI淀粉溶液,溶液呈蓝色. | |
| D. | 检验久置 Na2SO3是否变质,可用BaCl2溶液和稀硝酸. |
3.对达到平衡状态的可逆反应:A+B?C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是( )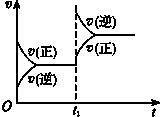

| A. | A、B都是气体,C、D都不是气体 | B. | A、B都是气体,C、D有一种是气体 | ||
| C. | C、D都是气体,A、B都是气体 | D. | C、D都是气体,A、B有一种是气体 |
20.下列反应中,生成物的总能量大于反应物的总能量的是( )
| A. | 氢气在氧气中燃烧 | B. | 焦炭在高温下与水蒸气反应 | ||
| C. | 铝与三氧化二铁高温反应 | D. | 铁丝在氧气中燃烧 |
17.下列说正确的是( )
| A. | 存在自由移动的离子是电解质溶液导电的原因 | |
| B. | 由于电流的作用,酸、碱、盐溶于水发生电离 | |
| C. | 电解质在熔融状态下都能导电 | |
| D. | 在水溶液中电离出氢离子的化合物属于酸 |
18.完成下表:
| 物质 | 物质的量/mol | 体积(标况)/L | 分子数 | 质量 |
| H2 | 0.5 | |||
| CO2 | 44.8 | |||
| N2 | 6.02×1022 | |||
| O2 | 32 |