题目内容
2.0.1mol•L-1的下列物质的水溶液中,氢离子浓度最大的是( )| A. | NH3•H2O | B. | NH4Cl | C. | HCl | D. | HCOOH |
分析 相同浓度的溶液中,c(H+)浓度大小顺序是:元数相同的强酸溶液大于弱酸,弱酸溶液大于盐水解而生成的氢离子浓度,盐水解而产生的氢离子浓度大于碱溶液中的氢离子浓度,据此分析解答.
解答 解:相同浓度的溶液中,盐酸是强酸、醋酸是弱酸溶液,氯化氢完全电离,醋酸分步分离,
氯化铵溶液中氢离子来源于铵根离子的水解,则促进水的电离,但铵根离子的水解较弱,
氨水是碱溶液,溶液中氢离子浓度更小,
则浓度相同时溶液中c(H+)浓度大小顺序是:HCl>CH3COOH>NH4Cl>NH3•H2O,
故选C.
点评 本题考查了溶液中氢离子浓度大小的比较,题目难度不大,先根据酸、盐、碱分类,再把相同类型的按强弱电解质分析解答即可,试题培养了学生分析能力及灵活应用能力.

练习册系列答案
相关题目
12.下列有关反 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-1025kJ•mol-1的描述不正确的是( )
| A. | 生成物的总能量小于反应物的总能量 | |
| B. | 该反应为放热反应 | |
| C. | 该反应每形成6mol H一O键,放出1025kJ热量 | |
| D. | 该反应中每4mol NH3(g)被氧化,放出l025kJ热量 |
13.在某密闭容器中存在下列化学平衡:aA(气)?bB(气)+cC(气),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是( )
| A. | 若a=b+c,B的物质的量分数变大 | B. | 若 a=b+c,B 的物质的量分数减小 | ||
| C. | 若a>b+c时,A的转化率不变 | D. | 若 a<b+c时,A的转化率变小 |
10.化学反应可视为旧化学键断裂和新化学键形成的过程.化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量.已知:N≡N键的键能是a kJ•mol-1,H-H键的键能是b kJ•mol-1;由N2和H2合成1mol NH3时可放出ckJ的热量.那么N-H键的键能是( )
| A. | $\frac{(a+3b-2c)}{2}$kJ•mol-1 | B. | $\frac{(a+3b+2c)}{6}$kJ•mol-1 | ||
| C. | $\frac{(a+3b-2c)}{6}$kJ•mol-1 | D. | $\frac{(a+3b+2c)}{3}$kJ•mol-1 |
17.下列有关氮气的叙述中错误的是( )
| A. | 氮气可作贮存水果、粮食的保护气 | |
| B. | 氮的非金属性比磷强,所以氮气的化学性质比磷活泼 | |
| C. | 在雷雨天,空气中的N2和O2反应生成NO | |
| D. | 氮气既可作氧化剂,又可作还原剂 |
7.下列物质均有漂白作用,其漂白原理相同的是( )
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧.
①过氧化钠 ②次氯酸 ③二氧化硫 ④活性炭 ⑤臭氧.
| A. | ①②③ | B. | ①③⑤ | C. | ①②⑤ | D. | ②③④ |
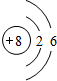 ;B在周期表的位置为第二周期ⅣA族;
;B在周期表的位置为第二周期ⅣA族;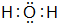 ;
;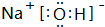 ;
;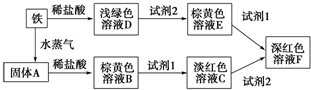 根据下列转化关系,回答有关问题:
根据下列转化关系,回答有关问题: