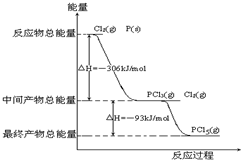
题目内容
4.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是( )| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
分析 可通过以下角度证明亚硝酸是弱电解质:
①证明酸部分电离;
②证明酸存在电离平衡;
③测定对应强碱盐的酸碱性;
④证明酸根离子存在水解平衡;
⑤强酸能够制取弱酸;
⑥证明酸加水稀释时能够继续电离,存在电离平衡.
解答 解:A.亚硝酸不稳定,易分解,说明说明亚硝酸中存在电离平衡,所以不能证明亚硝酸是弱酸,故A错误;
B.0.1 mol•L-1的亚硝酸溶液的pH<7,说明亚硝酸电离出氢离子而使其溶液呈酸性,但不能说明亚硝酸中存在电离平衡,则不能说明亚硝酸是弱酸,故B错误;
C.把pH=2的亚硝酸溶液稀释100倍后pH=3.5,说明亚硝酸中存在电离平衡,则说明亚硝酸是弱酸,故C正确;
D.100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应,说明亚硝酸是一元酸,但不能说明亚硝酸部分电离,所以不能证明亚硝酸是弱酸,故D错误;
故选C.
点评 本题考查弱电解质判断,强弱电解质的根本区别是电离程度,与电解质溶液导电性、电解质溶解性等无关,为易错点.

练习册系列答案
相关题目
14.下列有关化学用语或名称正确的是( )
| A. | 乙酸乙酯的结构简式:CH3CH2COOCH2CH3 | |
| B. | 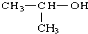 的名称:2-甲基乙醇 的名称:2-甲基乙醇 | |
| C. | 聚丙烯的结构简式为: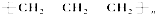 | |
| D. | CH4Si的结构式: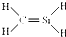 |
12.某主族元素R的原子其电子式可用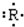 表示.该元素组成的以下物质,其分子式肯定错误的是( )
表示.该元素组成的以下物质,其分子式肯定错误的是( )
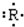 表示.该元素组成的以下物质,其分子式肯定错误的是( )
表示.该元素组成的以下物质,其分子式肯定错误的是( )| A. | 最高价氧化物分子式为R2O5 | B. | 含氧酸分子式为 HRO3 | ||
| C. | 含氧酸分子式为H3RO4 | D. | 气态氢化物分子式为RH5 |
19.表中列出了前20号元素中的某些元素性质的有关数据:
试回答下列问题:
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式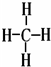 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式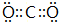 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式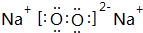 ;
;
(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
(1)以上10种元素的原子中,最容易失去电子的是②(填写编号);与H2最容易化合的非金属单质是氟气(写物质名称).
(2)写出元素⑤的氢化物结构式
 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式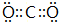 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;(3)某元素R的原子半径为1.02×10-10m,该元素在周期表中位于第三周期第ⅥA族,请画出它的阴离子结构示意图
 ,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+
,比较R的阴离子与②的阳离子半径大小(写离子符号)S2->K+(4)写出上述⑥、⑦两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的一种物质的分子式PCl3.
(5)写出④的最高价氧化物的水化物分别跟⑦和⑧的最高价氧化物的水化物反应的离子方程式3H++Al(OH)3=Al3++3H2O;OH-+Al(OH)3=AlO2-+2H2O.
9.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 现有元素周期表包括18个纵列,共16个族 |
16.A、B、C、D、E五种元素的原子的原子序数都小于18,且具有相同的电子层,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序( )
| A. | B、A、D、C、E | B. | C、D、B、A、E | C. | B、A、C、D、E | D. | C、D、A、B、E |