题目内容
9.关于元素周期表,下列叙述中不正确的是( )| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 现有元素周期表包括18个纵列,共16个族 |
分析 A.制备半导体材料的元素具有一定的金属性与非金属性;
B.优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)大多属于过渡元素;
C.制备新型农药材料的元素常见的是P、Cl等;
D.元素周期表有18个纵行,有7个主族、7个副族、1个零族、1个VIII族.
解答 解:A.在金属元素与非金属元素的分界线附近的元素具有一定的金属性与非金属性,可以在此寻找制备半导体材料的元素,故A正确;
B.优良的催化剂和耐高温、耐腐蚀的合金材料(如制造火箭、飞机的钛、钼等元素)大多属于过渡元素,故B正确;
C.制备新型农药材料的元素常见的是P、Cl等位于周期表的右上方,而元素周期表的左下角为活泼的金属元素,故C错误;
D.元素周期表有18个纵行,有7个主族、7个副族、1个零族、1个VIII族(为8、9、10三列),共有16个族,故D正确,
故选C.
点评 本题考查元素周期表的结构与应用,题目较为简单,注意对基础知识的理解掌握.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
19.下列有关工业生产的叙述正确的是( )
| A. | 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 | |
| B. | 硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 | |
| C. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 | |
| D. | 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
20.最近医学界通过用放射性15C跟踪标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关15C的叙述正确的是( )
| A. | 与C60中普通碳原子的化学性质不同 | |
| B. | 与16O的中子数相同 | |
| C. | 是足球烯的同素异形体 | |
| D. | 与12C互为同位素 |
17.下列有关氮气的叙述中错误的是( )
| A. | 氮气可作贮存水果、粮食的保护气 | |
| B. | 氮的非金属性比磷强,所以氮气的化学性质比磷活泼 | |
| C. | 在雷雨天,空气中的N2和O2反应生成NO | |
| D. | 氮气既可作氧化剂,又可作还原剂 |
4.亚硝酸(HNO2)的下列性质中,可以证明它是弱电解质的是( )
| A. | 亚硝酸不稳定,易分解 | |
| B. | 0.1 mol•L-1的亚硝酸溶液的pH<7 | |
| C. | 把pH=2的亚硝酸溶液稀释100倍后pH=3.5 | |
| D. | 100 mL l mol•L-1的亚硝酸溶液恰好与100 mL l mol•L-1的NaOH溶液完全反应 |
1.对于反应A+B═C+D,下列条件的改变一定使化学反应加快的是( )
| A. | 增加A的物质的量 | B. | 升高体系的温度 | C. | 减少C的物质的量 | D. | 增加体系的压强 |
18.下列各溶液中,Na+的物质的量浓度最大的是( )
| A. | 500mL 0.4mol/L NaOH溶液 | B. | 400mL 0.15mol/L Na3PO4溶液 | ||
| C. | 300mL 0.5mol/L NaCl 溶液 | D. | 200mL 0.3mol/LNa2SO4 |
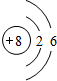 ;B在周期表的位置为第二周期ⅣA族;
;B在周期表的位置为第二周期ⅣA族;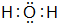 ;
;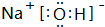 ;
;