题目内容
6.常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{{c(O{H^-})}}{{c({H^+})}}$=1×10-6,下列叙述正确的是( )| A. | 加水稀释,溶液的c(OH-)增大 | |
| B. | 此时,HA的电离平衡常数约为10-8 | |
| C. | 溶液中水电离出的H+的物质的量浓度约为10-10mol•L-1 | |
| D. | 与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+) |
分析 常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{{c(O{H^-})}}{{c({H^+})}}$=1×10-6,然后根据c(H+)•c(OH-)=10-14可知,解得c(H+)=10-4mol/L,c(OH-)=10-10mol/L.
A、加水稀释,溶液的酸性变弱,根据水的离子积不变来分析;
B、根据HA的电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$来计算;
C、由水电离出的c(H+)等于由水电离出的c(OH-);
D、根据溶液的电荷守恒来分析.
解答 解:常温下,0.1mol•L-1某一元酸(HA)溶液中$\frac{{c(O{H^-})}}{{c({H^+})}}$=1×10-6,然后根据c(H+)•c(OH-)=10-14可知,解得c(H+)=10-4mol/L,c(OH-)=10-10mol/L.
A、加水稀释,溶液的酸性变弱,即c(H+)变小,根据水的离子积不变可知,c(OH-)增大,故A正确;
B、0.1mol•L-1某一元酸(HA)溶液中,c(H+)=10-4mol/L,则c(A-)≈10-4mol/L,c(HA)=0.1mol/L-10-4mol/L≈10-4mol/L,故电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=10-7,故B错误;
C、溶液中c(H+)=10-4mol/L几乎全部来自于HA的电离,而c(OH-)=10-10mol/L全部来自于水的电离,而由水电离出的c(H+)等于由水电离出的c(OH-),故溶液中由水电离出的c(H+)=c(OH-)=10-10mol/L,故C正确;
D、与0.05 mol•L-1NaOH溶液等体积混合后,溶液中的溶质是等物质的量NaA和HA,如果所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+),则不遵循电荷守恒,故D错误;
故选AC.
点评 本题考查了弱电解质的电离,题目难度不大,本题的关键是根据溶液中c(H+)与c(OH-)的比值,结合溶液的离子积常数Kw计算出溶液的c(H+),判断出HA为弱酸,易错选项是D,注意溶液等体积混合后物质的浓度都减小,为易错点.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案| A. | 硝酸银 | B. | 氯化亚铁 | C. | 亚硫酸钠 | D. | 氯化铝 |
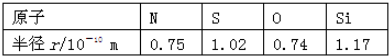
| A. | 0.70×10-10m | B. | 0.80×10-10m | C. | 1.10×10-10m | D. | 1.20×10-10m |
| A. | 臭氧转变为氧气 | |
| B. | 工业生产中氯化钠晶体的熔化、冷却 | |
| C. | 夏天马路洒水降温 | |
| D. | 日本大地震中用次氯酸溶液进行环境消毒 |
| A. | 向水中加入少量氢氧化钠固体 | B. | 向水中加入少量硫酸铝固体 | ||
| C. | 向水中加入少量碳酸钠固体 | D. | 将水加热到100℃,使水的pH=6 |
| A. | 甲、乙两试管都有白色沉淀生成 | B. | 甲、乙两管都没有白色沉淀生成 | ||
| C. | 甲管没有白色沉淀生成而乙试管有 | D. | 甲管有白色沉淀而乙试管没有 |
| A. | $\frac{(b-2c)}{a}$mol/L | B. | $\frac{(2b-c)}{a}$ mol/L | C. | $\frac{(2b-2c)}{a}$ mol/L | D. | $\frac{(2b-4c)}{a}$ mol/L |
| A. | 标准状况下,22.4 L任意比的O2和N2的混合气体中含有的分子总数均为NA | |
| B. | 标准状况下,14 g氮气含有的氮原子数为0.5NA | |
| C. | 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA | |
| D. | 标准状况下,22.4LH2O所含有的电子数是10NA |
 某化合物的结构(键线式)如图,下列关于该有机物的叙述正确的是( )
某化合物的结构(键线式)如图,下列关于该有机物的叙述正确的是( )| A. | 该有机物中含有8种类型的氢原子 | |
| B. | 1mol该有机物完全燃烧可以产生6mol水 | |
| C. | 该有机物属于芳香族化合物 | |
| D. | 该有机物一定条件下可以发生酯化反应 |