19.下列说法正确的是( )
| A. | 将钠放入水中,钠将沉在水底 | |
| B. | 将一小块钠放在稀盐酸中,钠将与水反应生成NaOH和H2,生成的NaOH再与HCl反应生成NaCl和H2O | |
| C. | 将一小块钠放在CuSO4溶液中发生如下反应:2Na+CuSO4═Na2SO4+Cu | |
| D. | Na2O和Na2O2中,氧元素化合价不同 |
18.在标准状况下,下列物质所占体积最大的是( )
| A. | 98 g H2SO4 | B. | 56 g Fe | C. | 44.8 L HCl | D. | 6 g H2 |
16.辉铜矿含铜成分高,是最重要的炼铜矿石,其主要成分为Cu2S.还含有Fe2O3、SiO2 及一些不溶性杂质.以辉铜矿为原料生产碱式碳酸铜的工艺流程如下:
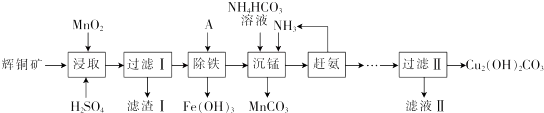
已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
回答下列问题:
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.

已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.
15.已知Ksp(CaSO4)=9.0×10-6,Ksp(CaCO3)=5.0×10-9,Ksp(CaF2)=1.5×10-10.某溶液中含有SO42-、CO32-和F-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的CaCl2溶液时,三种阴离子产生沉淀的先后顺序为( )
| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
14.下列有关乙醇汽油的说法正确的是( )
| A. | 乙醇汽油是一种纯净物 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 | |
| C. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| D. | 乙醇和乙二醇互为同系物 |
12.同温同压下,下列各组热化学方程式中,△H1<△H2 的是( )
0 170913 170921 170927 170931 170937 170939 170943 170949 170951 170957 170963 170967 170969 170973 170979 170981 170987 170991 170993 170997 170999 171003 171005 171007 171008 171009 171011 171012 171013 171015 171017 171021 171023 171027 171029 171033 171039 171041 171047 171051 171053 171057 171063 171069 171071 171077 171081 171083 171089 171093 171099 171107 203614
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H1 H2(g)+Cl2(g)═2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| D. | S(g)+O2(g)═SO2(g);△H1 S(s)+O2(g)═SO2(g);△H2 |
 “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.