题目内容
17.B、C、N、Si是几种常见的重要非金属元素,其形成的各种化合物在白然界中广泛存在.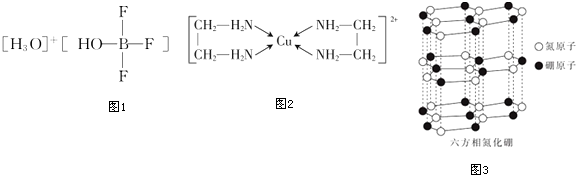
(1)基态硼原子的电子排布式为1s22s22p1.C、N、Si元素原子的第一电离能由大到小的顺序为N>C>Si.
(2)BF3 与一定量的水可形成如图1晶体R.
①晶体R中各种微粒间的作用力涉及abce(填字母).
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
②R中阴离子的空间构型为四面体.
(3)乙二胺(H2N-CH2-CH2-NH2)与CuCl2 溶液中形成配离子(结构如图2).乙二胺分子中氮原子的杂化类型为sp3杂化.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键.
(4)氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.它的晶体结构如图所示.六方相氮化硼是否含有π键?不含(填“含”或“不含”),其质地软的原因是层与层之间通过范德华力结合在一起,作用力小,导致其质地软;该物质3能否导电?不能(填“能”或“不能”),原因是层状结构中没有自由移动的电子.
(5)SiC是原子晶体,其品胞结构类似金刚石,假设正方体的边长为acm,估算SiC晶体的密度为$\frac{160}{{{a}^{3}•N}_{A}}$g.cm-3(用含NA、a的代数式表示).
分析 (1)根据构造原理写出硼原子的核外电子排布式;同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(2)晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,但三甲胺[N(CH3)3]分子之间不能形成氢键.
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软,六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电;
(5)该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=acm,体积V=(acm)3,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)硼原子核外有5个电子,其核外电子排布式为:1s22s22p1,同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,所以C、N、si三种元素的第一电离能由大到小的顺序为:N>C>Si,
故答案为:1s22s22p1;N>C>Si;
(2)①晶体R中各种微粒间的作用力涉及离子键、共价键、配位键、范德华力;
②阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式,为四面体构型;
故答案为:①abce;②四面体;
(3)乙二胺(H2N-CH2-CH2-NH2)中N原子呈3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化.
乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高.
故答案为:sp3杂化;乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(4)B位于第2周期ⅢA族,核外电子排布式1s22s22p1,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,形平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软,六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,该物质的层状结构中不存在自由移动的电子,所以不导电;
故答案为:不含;层与层之间通过范德华力结合在一起,作用力小,导致其质地软;不能;层状结构中没有自由移动的电子;
(5)该晶胞中C原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Si原子个数为4,晶胞边长=acm,体积V=(acm)3,ρ=$\frac{m}{V}$=$\frac{40×4}{{a}^{3}{N}_{A}}$g•cm3=$\frac{160}{{{a}^{3}•N}_{A}}$g•cm3;
故答案为:$\frac{160}{{{a}^{3}•N}_{A}}$•
点评 考查核外电子排布规律、电负性、杂化轨道、分子空间结构、氢键与化学键、晶胞等,综合性较强,难度中等,是对知识的综合运用,需要学生具备扎实的基础与分析问题解决问题的能力.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H1 H2(g)+Cl2(g)═2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| D. | S(g)+O2(g)═SO2(g);△H1 S(s)+O2(g)═SO2(g);△H2 |
| A. | 35.3g | B. | 33.5g | C. | 32.3g | D. | 11.3g |
| A. | 固体烧碱要密封存放 | |
| B. | 常时间放置的澄清石灰水变浑浊 | |
| C. | 浓硫酸露置于空气中会增重、变稀 | |
| D. | 铜制品长期放在空气中会产生“铜锈” |
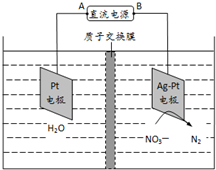 化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染. .
. 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:Cl2+H2O?HCl+HClO K=4.5×10-4