题目内容
16.辉铜矿含铜成分高,是最重要的炼铜矿石,其主要成分为Cu2S.还含有Fe2O3、SiO2 及一些不溶性杂质.以辉铜矿为原料生产碱式碳酸铜的工艺流程如下: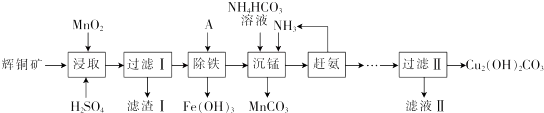
已知:①[Cu(NH3)4]SO4在常温下稳定,在热水中会分解生成NH3;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0mol•L-1 计算):
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Mn2+ | 8.3 | 9.8 |
| Cu2+ | 4.4 | 6.4 |
(1)能加快浸取速率的措施有粉碎矿石、升高温度(或适当增加酸的浓度或搅拌).(任写2条)
(2)浸取后得到的浸出液中含有CuSO4、MnSO4.写出浸取时产生CuSO4、MnSO4反应的化学方程式:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,滤渣I的成分为 MnO2、SiO2和S.
(3)“除铁”的方法是通过调节溶液pH,使 Fe3+水解转化为Fe(OH)3,加入的试剂A可以是氨水(填化学式),调节溶液pH的范围为3.2≤PH<4.4.
(4)“沉锰”(除Mn2+)过程中发生反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,“赶氨”时,最适宜的操作方法为加热.
(5)测定碱式碳酸铜纯度町用滴定法:称取6.2500g样品于100ml_小烧杯中,加入20ml.蒸馏水搅拌,再加入8ml.6mol•L-1 硫酸使其完全溶解,冷却后定量转移至250mL容量瓶中,加水定容,摇匀,移取25.00mL配好的溶液于锥形瓶中,加入40.OO mL0.2000mol•L-1 EDTA溶液,然后加入指示剂,再用0.2000mol•L-1的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL.已知EDTA与Cu2+、Zn2+均按物质的量比1:1反应,则样品中的Cu2(OH)2CO3质量分数为.78.14%.
分析 (1)矿石颗粒大小、温度、反应物浓度等因素影响反应速率;
(2)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,根据化合价升降相等配平,浸取后SiO2、反应生成的S都在滤渣Ⅰ中;
(3)过滤Ⅰ的溶液呈酸性,调节PH目的是除去Fe3+离子,可以用氨水,不会引入新杂质,根据阳离子生成氢氧化物沉淀的pH范围,选择PH范围;
(4)“沉锰”(除Mn2+)过程,主要是使Mn2+生成沉淀MnCO3,温度升高氨气在水中的溶解度减小;
(5)根据0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL,根据EDTA~Zn2+可求得与Zn2+反应的EDTA的物质的量为0.003600mol,而EDTA的总物质的量为40.00mL×0.2000mol•L-1=0.008000mol,所以与Cu2+反应的EDTA的物质的量为0.004400mol,根据EDTA~Cu2+可求得Cu2+的物质的量为0.004400mol,实验时将样品配成250mL,再取25.00mL,所以6.2500g样品中含有碳酸铜的物质的量为$\frac{250}{25}$×0.004400mol=0.04400mol,根据纯度=$\frac{纯碱式碳酸铜的质量}{样品的质量}$×100%可计算出样品中Cu2(OH)2CO2的质量分数.
解答 解:(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率,
故答案为:粉碎矿石、升高温度(或适当增加酸的浓度或搅拌);
(2)反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,浸取后SiO2、反应生成的S,都不溶解,都在滤渣Ⅰ中,
故答案为:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;SiO2、S;
(3)过滤Ⅰ的溶液呈酸性,调节PH目的是除去Fe3+离子,可以用氨水,不会引入新杂质,要除去滤液中的Fe3+离子,PH=3.2,Fe3+离子完全沉淀,PH=4.4,铜离子开始沉淀,故pH范围是3.2≤pH<4.4,
故答案为:氨水;3.2≤PH<4.4;
(4)“沉锰”(除Mn2+)过程,主要是使Mn2+生成沉淀MnCO3,反应的离子方程式为Mn2++HCO3-+NH3=MnCO3↓+NH4+,温度升高氨气在水中的溶解度减小,所以赶氨时,最适宜的操作方法为给溶液加热,
故答案为:Mn2++HCO3-+NH3=MnCO3↓+NH4+;加热;
(5)根据0.2000mol•L的Zn2+标准溶液滴定至终点,消耗标准溶液18.00mL,根据EDTA~Zn2+可求得与Zn2+反应的EDTA的物质的量为0.003600mol,而EDTA的总物质的量为40.00mL×0.2000mol•L-1=0.008000mol,所以与Cu2+反应的EDTA的物质的量为0.004400mol,根据EDTA~Cu2+可求得Cu2+的物质的量为0.004400mol,实验时将样品配成250mL,再取25.00mL,所以6.2500g样品中含有碳酸铜的物质的量为$\frac{250}{25}$×0.004400×$\frac{1}{2}$mol=0.02200mol,根据纯度=$\frac{纯碱式碳酸铜的质量}{样品的质量}$×100%可得样品中Cu2(OH)2CO2的质量分数=$\frac{0.02200×(64×2+17×2+60)}{6.2500}$×100%=78.14%,
故答案为:78.14%.
点评 本题考查了硫酸锰和碱式碳酸铜的制取,涉及的知识点比较多,可以根据信息及所学知识,合理分析得出正确结论,本题难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 化学键 | H-H | Cl-Cl | H-Cl |
| 键能∕(kJ•mol-1) | 436 | 243 | 431 |
| A. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=-91.5 kJ•mol-1 | |
| B. | H2(g)+Cl2(g)═2HCl(g)△H=-183 kJ•mol-1 | |
| C. | 0.5 H2(g)+0.5 Cl2(g)═HCl(g)△H=+91.5 kJ•mol-1 | |
| D. | 2HCl(g)═H2(g)+Cl2(g)△H=+183 kJ•mol-1 |
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol•L-1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:
 .
.