题目内容
19.下列说法正确的是( )| A. | 将钠放入水中,钠将沉在水底 | |
| B. | 将一小块钠放在稀盐酸中,钠将与水反应生成NaOH和H2,生成的NaOH再与HCl反应生成NaCl和H2O | |
| C. | 将一小块钠放在CuSO4溶液中发生如下反应:2Na+CuSO4═Na2SO4+Cu | |
| D. | Na2O和Na2O2中,氧元素化合价不同 |
分析 A.钠密度小于水;
B.金属钠和水的反应不如金属钠和酸之间的反应剧烈;
C.金属钠和盐溶液之间的反应是先和其中的水反应;
D.氧化钠中氧元素化合价为-2价,过氧化钠中氧元素为-1价.
解答 解:A.钠密度小于水,将钠放入水中,钠将浮在水面上,故A错误;
B.金属钠和水的反应不如金属钠和酸之间的反应剧烈,所以将一小块钠放在稀盐酸中,金属钠会和盐酸反应生成氯化钠和氢气,故B错误;
C.金属钠和硫酸铜溶液之间的反应是先和其中的水反应生成氢氧化钠和氢气,然后是氢氧化钠和硫酸铜之间发应生成氢氧化铜沉淀和硫酸钠,故C错误;
D.氧化钠中氧元素化合价为-2价,过氧化钠中氧元素为-1价,故D正确;
故选:D.
点评 本题考查了钠的性质,熟悉钠与水、盐溶液、酸反应是解题关键,注意与盐溶液反应实质先与水反应,题目难度不大.

练习册系列答案
相关题目
14.下列有关乙醇汽油的说法正确的是( )
| A. | 乙醇汽油是一种纯净物 | |
| B. | 乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染 | |
| C. | 乙醇和汽油都可作溶剂,也可相互溶解 | |
| D. | 乙醇和乙二醇互为同系物 |
8.下列热化学方程式书写正确且对应的△H与括号内表述相符的是( )
| A. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol(中和热) | |
| C. | H2O (g)=H2(g)+$\frac{1}{2}$O2(g)△H=-242 kJ/mol (反应热) | |
| D. | C(s)+O2( g )=CO2(g)△H=-393.5 kJ/mol(反应热) |
9.下列有关物质除杂、鉴别所用试剂或方法正确的是( )
| A. | 除去铁粉中混有的锌粉,可加入过量的硫酸亚铁溶液并过滤 | |
| B. | 用酚酞溶液可一次性鉴别稀硫酸、澄清石灰水、和氯化钠溶液 | |
| C. | 要除去CO2气体中的少量HCl气体,可将其通过足量的NaOH溶液 | |
| D. | 不加任何试剂即可鉴别KCl溶液、NaOH溶液、K2SO4溶液、CuSO4溶液 |

 某研究性学习小组设计如图装置来证实稀硝酸与铜反应生成了NO.
某研究性学习小组设计如图装置来证实稀硝酸与铜反应生成了NO.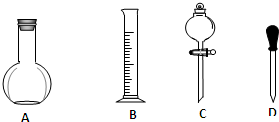 实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.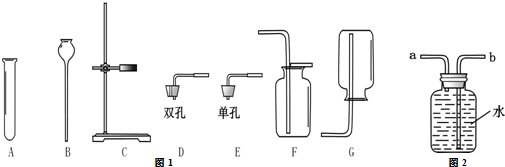
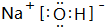 .
.