题目内容
12.同温同压下,下列各组热化学方程式中,△H1<△H2 的是( )| A. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| B. | $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H1 H2(g)+Cl2(g)═2HCl(g);△H2 | |
| C. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| D. | S(g)+O2(g)═SO2(g);△H1 S(s)+O2(g)═SO2(g);△H2 |
分析 A.S(g)具有的能量高于S(s),反应过程中气态硫放出的热量大于固态硫,反应热为负值,则△H1<△H2;
B.热化学方程式中放入的热量与化学计量数成正比,计量数越大,放出的热量越多,焓变△H值越小;
C.生成物中,气态水含有的能量大于液态水,则反应放出的热量减小,焓变变大;
D.碳不完全燃烧放出的热量小于完全燃烧放热的热量,据此进行判断两个反应的焓变大小.
解答 解:A.反应C(s)+$\frac{1}{2}$O2(g)═CO(g)中生成的一氧化碳还能够燃烧放出热量,属于碳不完全燃烧,比碳完全燃烧的反应C(s)+O2(g)═CO2(g)放热达到热量少,则焓变值要大,即:△H1>△H2,故A错误;
B.反应$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)的化学计量数是反应H2(g)+Cl2(g)═2HCl(g)的计量数的$\frac{1}{2}$,化学计量数越大,放出的热量越大,焓变△H越小,所以△H1>△H2,故B错误;
C.气态水的能量大于液态水,反应2H2(g)+O2(g)═2H2O(g)中生成气态水,而反应2H2(g)+O2(g)═2H2O(l)生成的是液态水,生成物含有的能量越高,则放出的热量越小,焓变△H值越大,则两个反应的焓变值大小为:△H1>△H2,故C错误;
D.S(g)具有的能量高于S(s),反应过程中S(g)+O2(g)═SO2(g)放出的热量大于S(s)+O2(g)═SO2(g),由于反应热为负值,放出的热量越多,焓变越小,则△H1<△H2,故D正确;
故选D.
点评 本题考查了反应热的大小比较,题目难度中等,注意掌握化学反应与能量变化的关系,明确放热反应中:放热的热量越大,焓变值越小;反应物具有的能量越高,放热的热量越大,焓变值越小;生成物具有的能量越高,放出的能量越小,焓变值越大.

Ⅰ.甲、乙两支试管分别盛甲烷和氯气的混合气体(以体积比1:1混合),其中一支用黑纸包好,将它们置于光线一般的室内,等待片刻,观察现象.请填写下表:
| 实验现象 | 实验结论 | |
| 甲 | 在光照条件下,试管内气体颜色变浅了;试管内壁上出现了油状液滴. | CH4与Cl2在光照条件下 发生化学反应 |
| 乙 | 迅速剥开黑纸,立即观察,试管内气体颜色为黄绿色. | CH4与Cl2在无光照条件下不发生化学反应. |
Ⅱ.为探究乙烯与溴的加成反应,因实验室制得的乙烯中通常会含有少量的SO2等杂质气体,该同学认为应先除去杂质,再通入溴水中.为此,他设计了如图所示的实验装置:
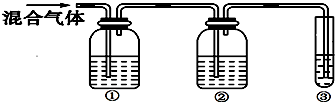
请回答:
(1)①、②、③装置中可盛放的试剂是:①A、②B、③C.(填序号)
A.NaOH溶液 B.品红 C.溴水 D.酸性高锰酸钾溶液
(2)除杂后,观察到溴水褪色,结合所学内容得出结论:乙烯可与溴水发生加成反应.请写出化学反应方程式CH2=CH2+Br2→
 .
.Ⅲ.为了探究苯与溴反应生成溴苯的实验,该同学采用下图所示装置,请分析装置并完成下列题目:

(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶中由A口加入过量溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为
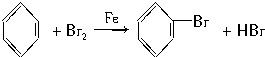
(2)D、E试管内出现的现象为石蕊溶液变红、出现淡黄色沉淀.
通过探究,该同学得出结论:甲烷、乙烯和苯在不同的条件下均能与卤素反应.
Ⅳ.现有H2、Cl2、乙烷、乙烯这四种原料,请你设计一种制取一氯乙烷的最佳实验方案,请用方程式表示出来(注意:原料不一定要全部选用).H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl.
| A. | 铝在空气中能很快形成氧化膜 | |
| B. | 铝箔失去金属光泽,氧化铝包裹着金属铝 | |
| C. | 氧化铝的熔点比铝高 | |
| D. | 氧化铝与盐酸不反应 |
 .
. 实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要用NaOH固体配制0.1mol/LNaOH溶液450mL和用浓硫酸配制0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.