题目内容
10. “神七”登天标志着我国的航天事业进入了新的篇章.
“神七”登天标志着我国的航天事业进入了新的篇章.(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温.为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是B.
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化D.该涂料不可能发生分解
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.已知:
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol-1
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ•mol-1
NO2(g)?$\frac{1}{2}$N2O4(g)△H=-26.35kJ•mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
(3)如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,燃料电池放电时的负极反应为:H2-2e-+2OH-=2H2O.如果某段时间内氢氧储罐中共收集到33.6L气体(已折算成标况),则该段时间内水电解系统中转移电子的物质的量为2mol.
(4)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.
有人提出,可以设计反应2CO═2C+O2(△H>0)来消除CO的污染.请你判断上述反应是否能发生?不可行,理由是:该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
分析 (1)涂料起散热作用,在一定条件下应该具有汽化或者分解的性质,因为物质汽化或者分解时从周围吸收热量,从而起到降温作用;
(2)根据盖斯定律,由已知热化学方程式乘以合适的系数进行适当的加减,反应热也乘以相应的系数进行相应的加减;
(3)氢气在负极发生氧化反应,注意碱性环境;某段时间内氢氧储罐中共收集到33.6L,为1.5mol气体,则生成氢气1mol,转移电子2mol,据此计算;
(4)阴极发生还原反应,CO2被还原生成CO;根据吉布斯自由能的大小判断反应能否进行.
解答 解:(1)涂料起散热作用,因为物质汽化或者分解时从周围吸收热量,从而起到降温作用,故该物质在高温下应该具有气化或者分解的性质;
故答案为:B;
(2)已知:①、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1
②、N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
③、NO2(g)?$\frac{1}{2}$N2O4(g)△H=-26.35kJ•mol-1
根据盖斯定律,②×2-①-③×2得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) 故△H=2×(-534.0kJ•mol-1)-67.7kJ•mol-1-2×(-26.35kJ•mol-1)=-1083.0kJ•mol-1,
故热化学方程式为2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1;
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1;
(3)氢气在负极发生氧化反应,在碱性环境中结合氢氧根离子生成水,电极反应式为H2-2e-+2OH-=2H2O;如果某段时间内氢氧储罐中共收集到33.6L,为1.5mol气体,电解方程式为2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,则生成1mol氢气和0.5mol氧气,生成1mol氢气转移电子2mol,所以该段时间内水电解系统中转移电子的物质的量为2mol,
故答案为:H2-2e-+2OH-=2H2O;2;
(4)阴极发生还原反应,CO2被还原生成CO,阴极反应为:2CO2+4e-+2H2O=2 CO+4OH-;
反应2CO=2C+O2(△H>0、△S<0),则△G=△H-T•△S>0,反应是一个焓增、熵减的反应,任何情况下不能自发进行,
故答案为:2CO2+4e-+2H2O=2CO+4OH-;不可行;该反应是一个焓增、熵减的反应,任何情况下不能自发进行.
点评 本题考查了范围广,题目难度大,注意氧化还原反应中的电子守恒、电极反应式书写及盖斯定律的应用.

 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案| A. | 1molNaC1中阴、阳离子数之和为2NA | B. | 0.3mol NH3中所含质子数为3NA | ||
| C. | 0.2molNa2SO4所带电荷数为0.2NA | D. | 2mol HNO3中所含原子数为10NA |
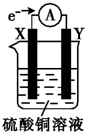 将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )
将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )| A. | 外电路中电流方向为X→Y | |
| B. | 若电极材料分别为锌片和铜片,则Y为锌片 | |
| C. | X极上发生还原反应 | |
| D. | 若电极材料都是金属,则金属活动性:X>Y |
| A. | SO42-、CO32-、F- | B. | CO32-、SO42-、F- | C. | CO32-、F-、SO42- | D. | F-、CO32-、SO42- |
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热时生成白色的过氧化钠 |
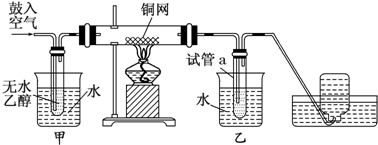
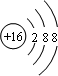 .
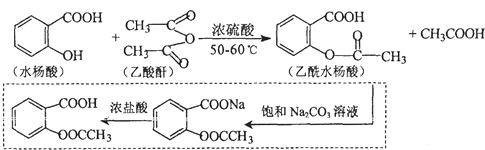
.
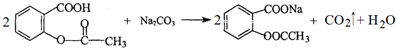
 .
.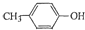 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: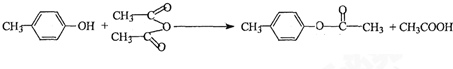 .
.