8.NA表示阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 标准状况下,22.4L的CH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,18g14CH4所含质子数目为10NA | |
| C. | 标准状况下的22.4L氯气与足量铁反应生成三氯化铁,转移的电子数目为3NA. | |
| D. | 0.1L 1mol/L的NH4C1溶液中存在的NH4+数目为0.1NA. |
7.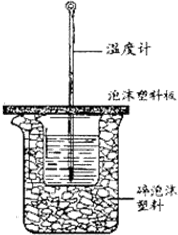 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
(3)利用本次实验数据计算所得中和热为-54.3kJ/mol (盐酸和NaOH溶液的密度按1g•cm-3,反应后混合溶液的热容按4.18J•g-1•℃-1计算).
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
| 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | ||
| 1 | 25.1 | 25.2 | 28.4 |
| 2 | 25.1 | 25.2 | 28.3 |
| 3 | 25.1 | 25.2 | 28.5 |
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).
5.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)?CH30H(g)△H,下表是该反应在不同温度下的化学平衡常数(K):
(1)由表中数据判断△H<0(填“>”、“=”或“<”).
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol•L-1,则此时的温度为310℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
①反应从2min到4min之间,H2的反应速率为0.3mol•L-1min-1.
②反应达到平衡时CO的转化率为62.5%.
③反应在第2min时改变了反应条件,改变的条件可能是a(填序号).
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳.该电池的负极反应式为:CH3OH+H2O=CO2+6H++6e-.若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为67.2 L.
| 温度/℃ | 250 | 310 | 350 |
| K/(mol•L-1)-2 | 2.041 | 0.250 | 0.012 |
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol•L-1,则此时的温度为310℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 浓度mol•L-1 时间/min | C(CO) | C(H2) | C(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
②反应达到平衡时CO的转化率为62.5%.
③反应在第2min时改变了反应条件,改变的条件可能是a(填序号).
a.使用催化剂 b.降低温度 c.增加H2的浓度
(4)常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1
(5)一种甲醇燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧化作用生成水和二氧化碳.该电池的负极反应式为:CH3OH+H2O=CO2+6H++6e-.若以上述燃料电池为电源来电解饱和食盐水,当消耗32g甲醇时,电解产生的H2体积(标况)为67.2 L.
1.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.根据下表中短周期元素的原子半径和主要化合价,回答表后的问题.
(1)上述元素中与元素⑧处于同一周期的有Mg、P、Cl(填元素符号)
(2)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(3)元素④构成的两种单质互称为同素异形体(填“同位素”、“同素异形体”或“同分异构体”)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤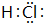 、②⑤
、②⑤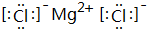 、③⑦
、③⑦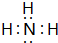
(5)工业制备⑧的过程中,被电解的物质是Al2O3(填化学式),属于离子(填“离子”或“共价”)化合物
(6)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.
0 170652 170660 170666 170670 170676 170678 170682 170688 170690 170696 170702 170706 170708 170712 170718 170720 170726 170730 170732 170736 170738 170742 170744 170746 170747 170748 170750 170751 170752 170754 170756 170760 170762 170766 170768 170772 170778 170780 170786 170790 170792 170796 170802 170808 170810 170816 170820 170822 170828 170832 170838 170846 203614
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 0.89 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(3)元素④构成的两种单质互称为同素异形体(填“同位素”、“同素异形体”或“同分异构体”)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤
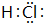 、②⑤
、②⑤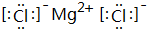 、③⑦
、③⑦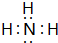
(5)工业制备⑧的过程中,被电解的物质是Al2O3(填化学式),属于离子(填“离子”或“共价”)化合物
(6)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.
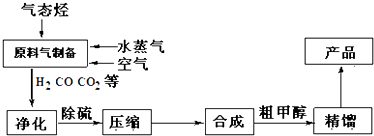

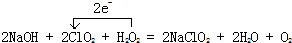 ;吸收装置中的温度不能过高,其原因是:防止H2O2的分解.
;吸收装置中的温度不能过高,其原因是:防止H2O2的分解.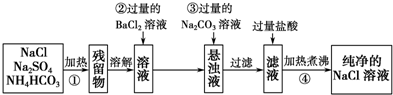


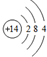 ;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).
;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).