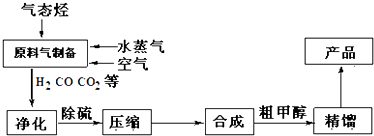
题目内容
4.现需要纯净的氯化钠溶液,但实验室中只有混有硫酸钠、碳酸氢铵的氯化钠固体.某同学设计了一个除去杂质获得纯净氯化钠溶液的实验方案.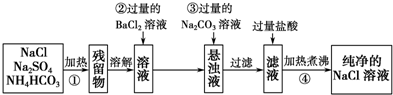
(1)操作①中发生反应的化学方程式是NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O.
(2)操作②中BaCl2溶液能否改用硝酸钡溶液不能(填“能”或“不能”).如果能,下一空不需要回答;如果不能,请说明理由:选用Ba(NO3)2溶液会引入新的杂质离子NO3-.
(3)写出操作③的离子方程式Ba2++CO32-=BaCO3↓.
(4)操作④的目的是除去溶解在溶液中的CO2气体和HCl.
分析 混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中发生加热条件下分解反应,分解后的固体溶于水后,与氯化钡反应除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后滤液中含NaCl、碳酸钠,加盐酸除去碳酸钠后溶质为NaCl,蒸发得到纯净的NaCl,以此来解答.
解答 解:混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中发生加热条件下分解反应,分解后的固体溶于水后,与氯化钡反应除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后滤液中含NaCl、碳酸钠,加盐酸除去碳酸钠后溶质为NaCl,蒸发得到纯净的NaCl,
(1)操作①中发生反应为碳酸氢铵受热分解生成氨气、二氧化碳和水,反应的化学方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,
故答案为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O;
(2)操作②反应是加入过量氯化钡溶液沉淀硫酸根离子生成硫酸钡沉淀,不能利用硝酸钡,引入新杂质离子硝酸根离子,
故答案为:不能;选用Ba(NO3)2溶液会引入新的杂质离子NO3-;
(3)操作③的反应是加入过量碳酸钠沉淀过量的被离子,反应的离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓;
(4)由于滤液中含有过量的氯化氢和溶解的二氧化碳气体,通过加热可以驱赶溶解在溶液中的CO2气体和HCl,故答案为:除去溶解在溶液中的CO2气体和HCl.
点评 本题考查混合物分离提纯实验方案的设计,为高频考点,把握流程中的化学反应及混合物分离方法为解答的关键,侧重分析与实验能力、推断能力的考查,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
7.有关元素的以下内容,随着原子序数的递增,不呈现周期性变化的是( )
| A. | 化合价 | B. | 原子半径 | C. | 最外层电子排布 | D. | 相对原子质量 |
12.如图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
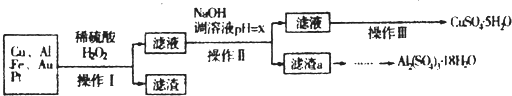
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式(Cu+H2O2+H2SO4=CuSO4+2H2O..
(2)在操作II中,x的取值范围是[5.2,5.4).
(3)在操作III中,蒸发浓缩需要的玻璃仪器有玻璃棒、酒精灯、烧杯.
(4)由滤渣a制取Al2(SO4)3.18H2O,探究小组设计了三种方案:
甲:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
乙:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$过滤$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
丙:滤渣a$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4.5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol.L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4.5H2O晶体的纯度是$\frac{15b}{a}$×100%.

已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式(Cu+H2O2+H2SO4=CuSO4+2H2O..
(2)在操作II中,x的取值范围是[5.2,5.4).
(3)在操作III中,蒸发浓缩需要的玻璃仪器有玻璃棒、酒精灯、烧杯.
(4)由滤渣a制取Al2(SO4)3.18H2O,探究小组设计了三种方案:
甲:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
乙:滤渣a$\stackrel{H_{2}SO_{4}}{→}$酸浸液$→_{过滤}^{适量Al粉}$过滤$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
丙:滤渣a$→_{过滤}^{NaOH溶液}$滤液$\stackrel{H_{2}SO_{4}}{→}$溶液液$\stackrel{操作置}{→}$Al2(SO4)3.18H2O
综合考虑上述三种方案,最具可行性的是乙(填序号).
(5)为测定CuSO4.5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol.L-1EDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4.5H2O晶体的纯度是$\frac{15b}{a}$×100%.
16.利用金属活动性的不同,可以采用不同的冶炼方法.下面关于金属冶炼叙述正确的是( )
| A. | 高炉炼铁采用了热分解法 | |
| B. | 电解氯化钠溶液冶炼金属钠 | |
| C. | 依据Fe+CuSO4═FeSO4+Cu的原理冶炼金属铜 | |
| D. | 金属冶炼的实质是将金属元素从其化合物中氧化出来 |
13.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 78g苯中含有碳碳双键数目为3NA | |
| B. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| C. | 常温常压下,46gNO2与N2O4的混合气体中含有的原子总数为3NA | |
| D. | 50mL12mol•L-1浓盐酸与足量二氧化锰加热反应,转移电子数小于0.3NA |
14.下列物质中既有离子键又有共价键的是( )
| A. | KCl | B. | SiO2 | C. | Na2O2 | D. | HNO3 |