题目内容
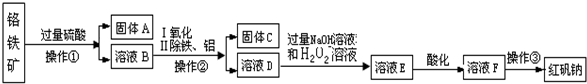
3.硫酸锌是制备荧光粉的原料之一.工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下.
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,6.5,9,7.
(1)浸取过程中提高浸出效率可采用的措施有将矿石粉碎或提高浸取温度或适当增加酸的浓度等(任答一条),ZnO和硫酸反应的化学方程式为ZnO+H2SO4=ZnSO4+H2O.
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②除去Cu2+.
(3)氧化过程中H2O2发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O.
(4)加入适量Ca(OH)2调节溶液pH,促进Fe3+水解,Fe3+水解反应的平衡常数表达式K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,Ca(OH)2不能过量的原因是防止生成Zn(OH)2.
分析 锌白矿中加入稀硫酸浸取,ZnO、Fe2O3、CuO分别和稀硫酸反应生成ZnSO4、Fe2(SO4)3、CuSO4,SiO2和稀硫酸不反应,然后过滤,得到的滤液中含有ZnSO4、Fe2(SO4)3、CuSO4、H2SO4,向滤液中混入Zn,将Fe3+还原为Fe2+,得到Cu沉淀,然后过滤,得到的滤液中含有ZnSO4、FeSO4,向滤液中加入双氧水,双氧水将Fe2+氧化为Fe3+,向溶液中加入少量氢氧化钙,溶液pH升高,铁离子转化为氢氧化铁沉淀,如果过滤,得到的滤液中含有ZnSO4,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnS04•7H2O.
(1)根据影响化学反应速率的因素;根据金属氧化物与酸反应生成盐和水;
(2)根据锌能和铜离子反应生成锌离子和铜,除去了铜离子;
(3)根据Fe2+能被H2O2氧化生成Fe3+,H2O2被还原成水;
(4)根据化学平衡常数是平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,注意当平衡中有固体物质以及水时,在平衡常数表达式中,就不写固体的浓度,水分子浓度;根据Ca(OH)2能和锌离子发生反应生成氢氧化锌.
解答 解:锌白矿中加入稀硫酸浸取,ZnO、Fe2O3、CuO分别和稀硫酸反应生成ZnSO4、Fe2(SO4)3、CuSO4,SiO2和稀硫酸不反应,然后过滤,得到的滤液中含有ZnSO4、Fe2(SO4)3、CuSO4、H2SO4,向滤液中混入Zn,将Fe3+还原为Fe2+,得到Cu沉淀,然后过滤,得到的滤液中含有ZnSO4、FeSO4,向滤液中加入双氧水,双氧水将Fe2+氧化为Fe3+,向溶液中加入少量氢氧化钙,溶液pH升高,铁离子转化为氢氧化铁沉淀,如果过滤,得到的滤液中含有ZnSO4,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到ZnS04•7H2O.
(1)浸取过程中,为提高浸出效率可采用的措施有,可将矿石粉碎或提高浸取时的温度,或适当增大酸的浓度等,ZnO与稀硫酸反应的化学方程式为ZnO+H2SO4(稀)═ZnSO4+H2O,
故答案为:将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可);ZnO+H2SO4═ZnSO4+H2O;
(2)锌能和铜离子反应生成锌离子和铜,除去了铜离子,故答案为:除去Cu2+;
(3)Fe2+能被H2O2氧化生成Fe3+,H2O2被还原成水,方程式为:H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(4)Fe3+水解反应的平衡常数表达式K=$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$,Ca(OH)2能和锌离子发生反应生成氢氧化锌,故答案为:$\frac{{c}^{3}({H}^{+})}{c(F{e}^{3+})}$;防止生成Zn(OH)2.
点评 本题以物质的制备为背景,考查了氧化还原反应、化学反应速率的影响因素、平衡常数等知识,明确物质的性质及实验步骤,知道流程图中发生的反应及基本操作方法、实验先后顺序等是解本题关键,题目难度中等.

| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3 - SO42- I- |
Ⅰ.取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2 溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+.
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O.
(3)甲同学最终确定原溶液中所含阳离子有Mg2+、Al3+,阴离子有Cl-、I-、NO3-、SO42-;并据此推测原溶液应该呈酸性,原因是Mg2++2H2O?Mg(OH)2+2H+、Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)另取100mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O.充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g.
| A. | 标准状况下,22.4L的CH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,18g14CH4所含质子数目为10NA | |
| C. | 标准状况下的22.4L氯气与足量铁反应生成三氯化铁,转移的电子数目为3NA. | |
| D. | 0.1L 1mol/L的NH4C1溶液中存在的NH4+数目为0.1NA. |
| A. | 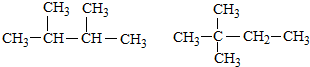 | |
| B. | 液氯、氯气 | |
| C. | O2、O3 | |
| D. | ${\;}_{17}^{35}Cl$、${\;}_{17}^{37}Cl$ |
| A. | 可燃冰释放的甲烷属于烃 | B. | 可燃冰是水变油,属于化学变化 | ||
| C. | 甲烷与异丁烷为同系物 | D. | 天然气是一种重要的化工原料 |
| A. | 乙烷和乙烯都能与氢气在一定条件下发生加成反应 | |
| B. | 乙醇,乙酸均能与氢氧化钠溶液反应生成盐和水 | |
| C. | 高分子化合物是指相对分子质量大于1000的化合物 | |
| D. | 乙醇,乙酸和乙酸乙酯用饱和Na2CO3溶液鉴别 |