题目内容
7.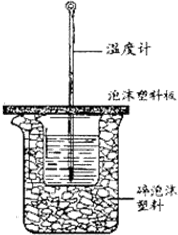 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条或塑料泡沫的作用是减少实验过程中的热量损失.
| 起始温度T1/℃ | 终止温度 T2/℃ | ||
| HCl | NaOH | ||
| 1 | 25.1 | 25.2 | 28.4 |
| 2 | 25.1 | 25.2 | 28.3 |
| 3 | 25.1 | 25.2 | 28.5 |
(4)已知中和热△H=-57.36kJ/mol,你认为造成上述误差的原因可能是BC.
A.在量取盐酸时仰视读数
B.把量筒中的氢氧化钠倒入小烧杯时动作迟缓
C.大烧杯上未盖硬纸板
(5)大烧杯上如不盖硬纸板,求得的中和热的绝对值偏小(填“偏大”、“偏小”或“无影响”).
(6)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量不相等(填“相等、不相等”),所求中和热相等(填“相等”或“不相等”).
(7)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的绝对值会偏小(填“偏大”、“偏小”或“无影响”).
分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)先根据表中测定数据计算出混合液反应前后的平均温度差,再根据Q=m•c•△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)A.在量取盐酸时仰视读数,会使得实际量取体积高于所要量的体积,放出的热量偏多;
B、把量筒中的氢氧化钠倒入小烧杯时动作迟缓,会导致一部分能量的散失;
C、大烧杯上未盖硬纸板,会导致一部分能量散失;
(5)不盖硬纸板,会有一部分热量散失;
(6)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(7)弱电解质电离吸收热量.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)第1次实验盐酸和NaOH溶液起始平均温度为25.15℃,反应后温度为:28.4℃,温度差为:3.25℃;
第2次实验盐酸和NaOH溶液起始平均温度为25.15℃,反应后温度为:28.3℃,反应前后温度差为:3.15℃;
第3次实验盐酸和NaOH溶液起始平均温度为25.15℃,反应后温度为:28.5℃,反应前后温度差为:3.35℃;
三次温度差的平均值为3.25℃,用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100mL×1g/cm3=100g,温度变化的值为△T=3.25℃,则放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.25℃=1358.5J,即1.3585KJ,所以实验测得的中和热△H=-$\frac{1.3585KJ}{0.025mol}$=-54.3kJ/mol,故答案为:-54.3kJ/mol;
(4)A.在量取盐酸时仰视计数,会使得实际量取体积高于所要量的体积,放出的热量偏多,实验测得中和热的数值偏大,故A错误;
B、把量筒中的氢氧化钠倒入小烧杯时动作迟缓,会导致一部分能量的散失,放出的热量偏少,实验测得中和热的数值偏小,故B正确;
C、大烧杯上未盖硬纸板,会导致一部分能量散失,放出的热量偏少,实验测得中和热的数值偏小,故C正确;
故选:BC;
(5)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
(6)反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,测得中和热数值不变;
故答案为:不相等;相等;
(7)NH3•H2O为弱碱,电离过程为吸热过程,所以用NH3•H2O代替稀氢氧化钠溶液反应,反应放出的热量偏小,测得的中和热的绝对值会偏小,故答案为:偏小.
点评 本题主要考查了反应热的测定与计算,难度不大,注意理解中和热的概念以及测定反应热的误差等问题.

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
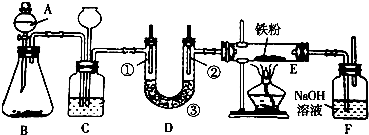
(1)欲利用浓盐酸与B不加热制取氯气,则B可选用下列物质中的bc;
a.MnO2 b.Ca(ClO)2 c.KMnO4 d.NaCl
(2)C装置的作用是安全瓶;C中加入饱和食盐水 溶液;当C后面的装置发生堵塞时,C中的现象是:长颈漏斗中液面上升.
(3)装置D用于验证氯气的漂白性,①是湿润的有色布条 ③是无水氯化钙或五氧化二磷
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
| 实验方法 | 实验现象 | 实验结论 |
| 1.取反应初始阶段(氯气不足量)E中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液,①加入KSCN溶液,②加入KMnO4溶液 | ① ② | 生成物中没有FeCl2 生成物中含有FeCl3 |
| 2.取充分反应后(氯气通入足够长时间)E中产物,溶于水中,加入KMnO4溶液 | KSCN溶液显红色, KMnO4溶液不褪色 |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl+HCl | B. | 2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O | ||
| C. | CH2=CH2+Br2$\stackrel{一定条件}{→}$CH2BrCH2Br | D. | 3NO2+H2O═2HNO3+NO |
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | C(石墨)→C(金刚石) | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2 |

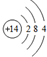 ;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).
;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).