题目内容
6.亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:
①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O.
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
③160g/L NaOH溶液是指160g NaOH固体溶于水所得溶液的体积为1L.
(1)160g/L NaOH溶液的物质的量浓度为:4.00mol/L(结果保留三位有效数字)
(2)发生器中鼓入空气的作用是:稀释ClO2,防止ClO2分解爆炸.
(3)写出吸收装置内发生反应的化学方程式,并标出电子转移方向和数目:
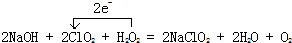 ;吸收装置中的温度不能过高,其原因是:防止H2O2的分解.
;吸收装置中的温度不能过高,其原因是:防止H2O2的分解.(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是bed(选填序号)
a.蒸发结晶 b.蒸发浓缩 c.灼烧 d.过滤 e.冷却结晶.
分析 ClO2在二氧化硫和空气混合气体中不易分解爆炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,计算氢氧化钠的物质的量.利用c=$\frac{n}{V}$计算氢氧化钠溶液的物质的量浓度;
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,据此解答;
(3)根据题目信息并运用氧化还原反应理论判断反应物、生成物.根据流程信息可知,吸收塔内生成NaClO2,一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,据此书写方程式,温度过高,H2O2容易分解;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.得到的粗晶体经过重结晶可得到纯度更高的晶体.
解答 解:ClO2在二氧化硫和空气混合气体中不易爆分解炸,在吸收塔中挤入氢氧化钠溶液和过氧化氢发生氧化还原反应生成NaClO2,NaClO2的溶解度随温度升高而增大,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体NaClO2•3H2O,
(1)浓度g/L表示1L溶液中所含溶质质量的多少.160g/LNaOH溶液表示1L氢氧化钠溶液含有160gNaOH.令溶液体积为1L,则160gNaOH的物质的量为$\frac{160g}{40g/mol}$=4mol.所以该溶液氢氧化钠的物质的量浓度c(NaOH)=$\frac{4mol}{1L}$=4.00mol/L.
故答案为:4.00mol/L.
(2)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全,所以发生器中鼓入空气的作用应是稀释ClO2以防止爆炸,
故答案为:稀释ClO2,防止ClO2分解爆炸;
(3)吸收装置内发生反应的化学方程式并标出电子转移方向和数目为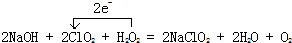 ,因为双氧水受热会分解,所以吸收装置中的温度不能过高,
,因为双氧水受热会分解,所以吸收装置中的温度不能过高,
故答案为: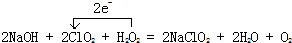 ;防止H2O2的分解;
;防止H2O2的分解;
(4)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体.所以操作顺序为bed,
故答案为:bed.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度.

| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,温度一定时,压强不随时间改变 |
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 0.89 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(2)①④⑦三种元素的氢化物的稳定性由强到弱的顺序为H2O>NH3>PH3(填化学式)
(3)元素④构成的两种单质互称为同素异形体(填“同位素”、“同素异形体”或“同分异构体”)
(4)请写出下列元素形成的常见化合物的电子式:
③⑤
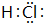 、②⑤
、②⑤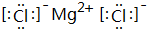 、③⑦
、③⑦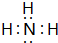
(5)工业制备⑧的过程中,被电解的物质是Al2O3(填化学式),属于离子(填“离子”或“共价”)化合物
(6)请写出⑤⑧两种元素的最高价氧化物对应水化物间反应的离子方程式:3H++Al(OH)3═Al3++3H2O.

已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
| 离子符号 | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 2.5 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.7 | 6.7 |
(2)滤渣A的成分有SiO2(填化学式),检验滤液C中的Fe3+离子是否除尽的方法是取滤液C少量于试管中,滴加几滴KSCN溶液,若溶液变为血红色,证明滤液C中的Fe3+离子未除尽,反之已除尽.
(3)第④步蒸发操作必要的仪器有铁架台(含铁圈)、坩埚钳、石棉网、酒精灯、蒸发皿、玻璃棒.需要在氯化氢气流中蒸干制取无水氯化铜的原因是HCl抑制CuCl2水解.
(4)称取30.250g已制得的无水CuCl2产品(含少量FeCl3杂质),溶于水中,加入过量的铁粉充分反应后过滤,得250mL滤液,量取25.00mL滤液于锥形瓶中,用0.100mol?L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液体积平均为46.00mL,则该无水CuCl2产品中CuCl2的质量分数为0.89(用小数表示,计算结果保留2位小数).
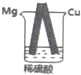
| A. | 是将化学能转化成电能的装置 | |
| B. | Cu上有气体放出 | |
| C. | Mg是负极,电极反应是Mg-2e-═Mg2+ | |
| D. | 导线中有电流通过,电流方向是由Mg到Cu |
| A. | 目前工业废气脱硫应用最广泛的方法是石灰法 | |
| B. | 工业上通过电解熔融的MgCl2获得金属Mg | |
| C. | 钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 | |
| D. | 高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁 |