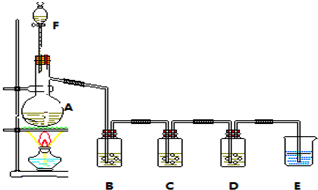
13.利用下图装置探究温度对氨气还原Fe2O3的影响(固定装置略).
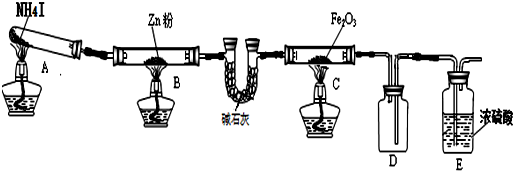
完成下列填空:
(1)实验时A中有大量紫红色的烟气,烟气的主要成份是NH3、H2、I2、HI,在上图装置中,碱石灰的作用是吸收混合气体中的HI;
(2)装置B中,Zn会与I2发生反应,其反应化学方程式Zn+I2═ZnI2
-;
(3)按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末 (纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
?乙组得到的黑色粉末是Fe;?步骤1甲组中反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)若装置C中反应后的固体是Fe2O3和FeO组成的混合物.为确定其组成,取样品7.84克,在加热 条件下通入足量的氨气,完全反应后,停止加热,Fe2O3和FeO都被还原为Fe,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe2O3和FeO的物质的量之比为2:1.

完成下列填空:
(1)实验时A中有大量紫红色的烟气,烟气的主要成份是NH3、H2、I2、HI,在上图装置中,碱石灰的作用是吸收混合气体中的HI;
(2)装置B中,Zn会与I2发生反应,其反应化学方程式Zn+I2═ZnI2
-;
(3)按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末 (纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(4)若装置C中反应后的固体是Fe2O3和FeO组成的混合物.为确定其组成,取样品7.84克,在加热 条件下通入足量的氨气,完全反应后,停止加热,Fe2O3和FeO都被还原为Fe,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe2O3和FeO的物质的量之比为2:1.
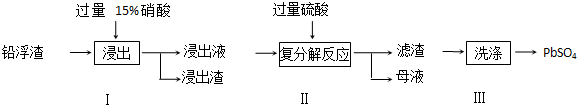
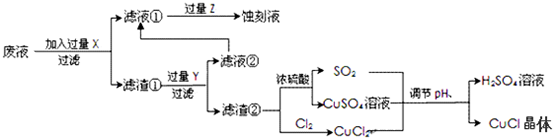
11.铁及其化合物在生产和生活中有广泛的应用.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的方法之一的反应原理为:Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
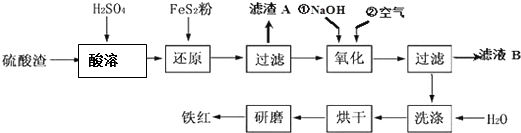
已知:①
②FeS2是一种黄色难溶于水的固体.
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式:FeS2+14 Fe3++8 H2O=15Fe2++2 SO42-+16 H+.
(3)为了确保铁红的质量和纯度,氧化过程中加NaOH调节溶液的pH的范围是3.2~3.8;如果加NaOH调节溶液的pH=a,则滤液B中的c(Fe3+)=4×10(4-3a)(25℃时,Ksp[Fe(OH)3]=4×10-38)
(4)滤液B中可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4.
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的方法之一的反应原理为:Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:

已知:①
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式:FeS2+14 Fe3++8 H2O=15Fe2++2 SO42-+16 H+.
(3)为了确保铁红的质量和纯度,氧化过程中加NaOH调节溶液的pH的范围是3.2~3.8;如果加NaOH调节溶液的pH=a,则滤液B中的c(Fe3+)=4×10(4-3a)(25℃时,Ksp[Fe(OH)3]=4×10-38)
(4)滤液B中可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4.
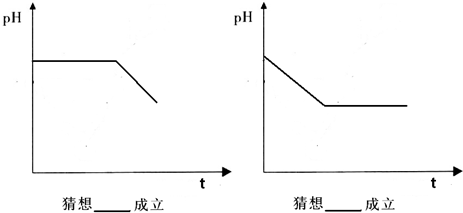
10.Ⅰ.为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入0.5mol/L Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论.
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.已知:
请回答:(1)请利用所提供的试剂,帮助乙同学完成实验方案设计.
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、5mol/L硝酸钠溶液、0.5mol/L硝酸钠溶液、0.1mol/L稀盐酸、蒸馏水.
方案测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(2)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
①据实验现象写出发生反应的离子方程式:Cu+2Fe3+=Cu2++2Fe2+.
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
③解释乙同学的实验现象在此酸性条件下NO3-不能氧化Cu.
(3)请你设计更简便可行的实验方案,帮助甲同学达到实验目的将铜片放入0.5mol/L氯化铁溶液中.
Ⅱ.聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.505 0g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.100 0mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0g白色沉淀.(相对原子质量或式量:Fe-56 Al-27 Cl-35.5 O-16 H-1 Fe2O3-160 Al2O3-102 AgCl-143.5 H2O-18)
(4)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将偏低(填“偏高”“偏低”或“不变”).
(5)通过计算确定PAFC的化学式[FeAl3(OH)9Cl3•3H2O]m或FeAl3(OH)9Cl3•3H2O(写出计算过程;不要求写出反应方程式;m为聚合度,不必求出).
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究.已知:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、5mol/L硝酸钠溶液、0.5mol/L硝酸钠溶液、0.1mol/L稀盐酸、蒸馏水.
方案测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应.
(2)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下.
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
②导致实验过程中溶液pH略有上升的可能原因是Fe3+变为Cu2+和Fe2+,水解能力下降.
③解释乙同学的实验现象在此酸性条件下NO3-不能氧化Cu.
(3)请你设计更简便可行的实验方案,帮助甲同学达到实验目的将铜片放入0.5mol/L氯化铁溶液中.
Ⅱ.聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb•zH2O]m.某同学为测定其组成,进行如下实验:①准确称取4.505 0g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0g固体.②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+.用0.100 0mol•L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00mL.③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0g白色沉淀.(相对原子质量或式量:Fe-56 Al-27 Cl-35.5 O-16 H-1 Fe2O3-160 Al2O3-102 AgCl-143.5 H2O-18)
(4)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将偏低(填“偏高”“偏低”或“不变”).
(5)通过计算确定PAFC的化学式[FeAl3(OH)9Cl3•3H2O]m或FeAl3(OH)9Cl3•3H2O(写出计算过程;不要求写出反应方程式;m为聚合度,不必求出).
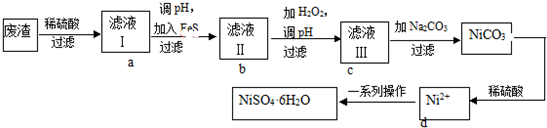
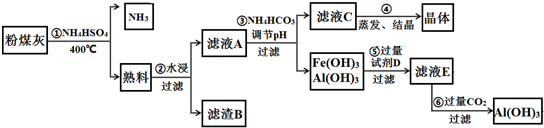
7.CoCl2•6H2O是一种饲料营养强化剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
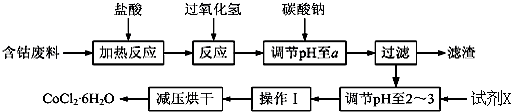
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(写两点).
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为盐酸.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水(写出两个原因).
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后过滤、蒸馏(填实验操作)获得纯净的CoCl2•6H2O.
0 169863 169871 169877 169881 169887 169889 169893 169899 169901 169907 169913 169917 169919 169923 169929 169931 169937 169941 169943 169947 169949 169953 169955 169957 169958 169959 169961 169962 169963 169965 169967 169971 169973 169977 169979 169983 169989 169991 169997 170001 170003 170007 170013 170019 170021 170027 170031 170033 170039 170043 170049 170057 203614

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染;防止产品中混有硝酸盐(写两点).
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;pH调至a后过滤,再用试剂X将滤液的pH调节至2-3,则所用的试剂X为盐酸.
(3)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(4)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(5)为测定产品中CoCl2•6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量.通过计算发现产品中CoCl2•6H2O的质量分数大于100%,其原因可能是样品中含有NaCl杂质,CoCl2•6H2O烘干时失去了部分结晶水(写出两个原因).
(6)在实验室中,为了从上述产品中获得纯净的CoCl2•6H2O,常将制得的产品溶解于乙醚中,然后过滤、蒸馏(填实验操作)获得纯净的CoCl2•6H2O.

 ,
,