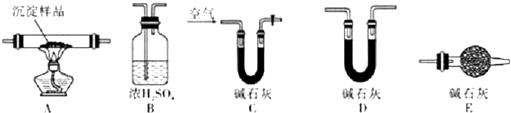
题目内容
13.利用下图装置探究温度对氨气还原Fe2O3的影响(固定装置略).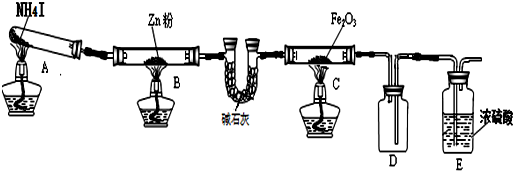
完成下列填空:
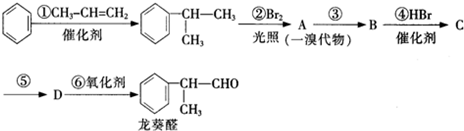
(1)实验时A中有大量紫红色的烟气,烟气的主要成份是NH3、H2、I2、HI,在上图装置中,碱石灰的作用是吸收混合气体中的HI;
(2)装置B中,Zn会与I2发生反应,其反应化学方程式Zn+I2═ZnI2
-;
(3)按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置C加热,反应产物均为黑色粉末 (纯净物),两组分别用各自的产物进行以下探究,完成下列填空:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无明显变化 |
| 3 | 向步骤2溶液中滴加新制氯水 | 红色先变深后褪去 | 先变红后也褪色 |
(4)若装置C中反应后的固体是Fe2O3和FeO组成的混合物.为确定其组成,取样品7.84克,在加热 条件下通入足量的氨气,完全反应后,停止加热,Fe2O3和FeO都被还原为Fe,反应管中铁粉冷却后,称得质量为5.6克,则混合物中Fe2O3和FeO的物质的量之比为2:1.
分析 (1)混合气体中含有碘化氢,用碱石灰可以吸收碘化氢;
(2)装置B中锌的作用是吸收碘蒸气,反应方程式:Zn+I2═ZnI2;
(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”判断乙组黑色粉末组成;Fe2O3被还原得到黑色固体为Fe3O4,由此可写出反应的离子方程式;
(4)氧化物样品质量为7.84克,还原成铁粉质量为5.6克,设出氧化铁和氧化亚铁的物质的量,分别根据铁的质量、总质量列式计算即可.
解答 解:(1)混合气体的碘化氢会干扰实验,则C装置中的碱石灰作用是吸收混合气体中的碘化氢,
故答案为:吸收混合气体中的HI;
(2)装置B的作用是吸收碘蒸气,锌与碘单质反应生成碘化锌,反应的化学方程式为:Zn+I2═ZnI2,
故答案为:Zn+I2═ZnI2;
(3)利用黑色固体可溶于盐酸并产生气体,结合“原子守恒”可知用酒精喷灯的乙组实验得到的固体为Fe;
根据甲组现象可知,Fe2O3与氨气在酒精灯加热的条件下,Fe2O3被还原得到黑色固体为Fe3O4,四氧化三铁与盐酸反应生成氯化铁和氯化亚铁,反应的离子方程式为:Fe3O4+8H+=2Fe3++Fe2++4H2O,
故答案为:Fe;Fe3O4+8H+=2Fe3++Fe2++4H2O;
(4)设氧化铁的物质的量为x,氧化亚铁的物质的量为y,则:160x+72y=7.84、(2x+y)×56=5.6,
联立解得:x=0.04mol、y=0.02mol,
则混合物中Fe2O3和FeO的物质的量之比为:0.04mol:0.02mol=2:1,
故答案为:2:1.
点评 本题考查性质实验方案的设计与评价,题目难度中等,注意掌握铁离子、亚铁离子的检验方法、混合物反应的计算及性质实验方案的设计与评价原则,试题综合性较强,注意正确理解、分析题中信息,试题培养了学生的分析能力及化学实验、化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 热稳定性:HCl>HF>H2O | B. | 沸点:金刚石>冰>干冰 | ||
| C. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 | D. | 元素的最高正化合价:F>S>C |
 ;
;  ;
;