题目内容
14.硫酸铅广泛应用于制造蓄电池、白色颜料等.利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下: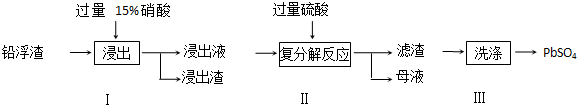
已知铅浮渣的主要成分是PbO、Pb,还含有少量Zn、CaO和其他不溶于硝酸的杂质.25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8.
回答下列问题:
(1)已知步骤Ⅰ中还原产物只有NO,浸出液中的金属阳离子主要是Pb2+.分别写出PbO、Pb与硝酸反应的化学方程式PbO+2HNO3=Pb(NO3)2+H2O、3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O.
(2)若将步骤Ⅱ中的Pb2+完全转化成PbSO4沉淀,则溶液中的c(SO42-)至少为:1.6×10-3mol/L.
(3)母液可循环用于步骤Ⅰ,其可利用的溶质主要是HNO3(填化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是浸出时部分Pb2+生成PbSO4随浸出渣排出,降低PbSO4的产率.
(4)步骤Ⅲ中需用Pb(NO3)2溶液多次洗涤滤渣,分离得产品PbSO4.目的是除去CaSO4,离子反应方程式CaSO4+Pb2+=PbSO4+Ca2+.
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为PbSO4+2e-=Pb+SO42-.
分析 (1)氧化铅属于碱性氧化物和硝酸反应生成盐和水,根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,据此写出方程式;
(2)Pb2+完全转化成PbSO4沉淀离子浓度小于10-5mol/L,结合溶度积计算;
(3)Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,过滤得滤液含硝酸;若母液中残留的SO42-过多,浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4;
(5)充电过程中原电池的负极连接电源负极做电解池的阴极发生还原反应.
解答 解:(1)氧化铅属于碱性氧化物和硝酸反应生成盐和水,根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,故反应方程式为PbO+2HNO3=Pb(NO3)2+H2O、3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
故答案为:PbO+2HNO3=Pb(NO3)2+H2O;3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
(2)Pb2+完全转化成PbSO4沉淀离子浓度小于10-5mol/L,Ksp(PbSO4)=1.6×10-8.则c(SO42-)=$\frac{Ksp}{1{0}^{-5}}$=$\frac{1.6×1{0}^{-8}}{1{0}^{-5}}$=1.6×10-3mol/L,
故答案为:1.6×10-3mol/L;
(3)Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,其溶质主要是HNO3,
若母液中残留的SO42-过多,浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
故答案为:HNO3;浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率;
(4)硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,离子方程式为:CaSO4+Pb2+=PbSO4+Ca2+,
故答案为:Pb(NO3)2,CaSO4杂质,CaSO4+Pb2+=PbSO4+Ca2+;
(5)充电过程中原电池的负极连接电源负极做电解池的阴极发生还原反应,电极反应为:PbSO4+2e-=Pb+2SO42-,故答案为:PbSO4+2e-=Pb+SO42-.
点评 本题考查了生产硫酸铅的工艺流程、硝酸的性质等,还涉及基本的实验操作,考查学生分析问题和解决问题的能力,题目难度中等.

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
| A. | 测定某补血剂(成分FeSO4和维生素C)中铁元素的含量,将一定质量的补血剂溶于水,然后用标准浓度的酸性高锰酸钾溶液滴定至溶液恰好变紫色且半分钟不改变 | |
| B. | 测量SO2、N2混合气体中SO2含量,将标准状况下一定体积混合气体通过装有一定浓度一定体积的碘-淀粉溶液的反应直至溶液蓝色恰好消失 | |
| C. | 测定氯化铵与硫酸铵混合物中氯化铵的含量,将一定质量的混合物溶于水,再加入过量氯化钡溶液至沉淀不再生成,过滤、洗涤、干燥,再称重 | |
| D. | 测定硫酸铜晶体(CuSO4•xH2O)里结晶水的含量,将一定质量的硫酸铜晶体加热至蓝色变白,冷却,称量,重复至前后质量恒定 |
 4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7 kJ/mol
 ;
;