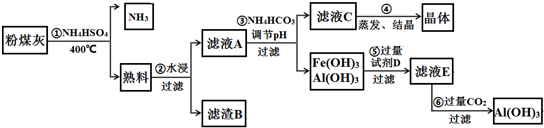
题目内容
11.铁及其化合物在生产和生活中有广泛的应用.Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的方法之一的反应原理为:Fe(OH)3+NaClO+NaOH→Na2FeO4+X+H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆.工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
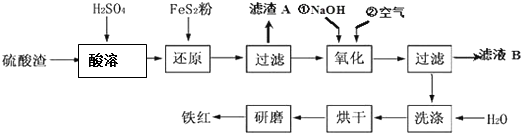
已知:①
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式:FeS2+14 Fe3++8 H2O=15Fe2++2 SO42-+16 H+.
(3)为了确保铁红的质量和纯度,氧化过程中加NaOH调节溶液的pH的范围是3.2~3.8;如果加NaOH调节溶液的pH=a,则滤液B中的c(Fe3+)=4×10(4-3a)(25℃时,Ksp[Fe(OH)3]=4×10-38)
(4)滤液B中可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4.
分析 Ⅰ、氧化还原反应元素化合价升降分析配平化学方程式,根据质量守恒定律的实质,反应前后各元素的原子个数相等推断X的化学式,元素化合价升高失电子钡氧化;
Ⅱ、硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
(1)氧化铁属于碱性氧化物,与酸反应生成盐和水;Fe2O3、Al2O3、MgO都和硫酸反应,二氧化硅不和酸反应;
(2)根据得失电子守恒和原子守恒来配平,FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16;
(3)根据几种离子沉淀的pH,应选择使Fe3+沉淀完全而其他离子不沉淀,结合溶度积常数计算分析;
(4)根据几种离子沉淀的pH分析;因加入的是氢氧化钠来调节PH,所以滤液B中应是未沉淀离子的硫酸盐和硫酸钠.
解答 解:Ⅰ、根据元素化合价变化配平书写化学方程式,铁元素化合价+3价变化为+6价,氯元素化合价+1价应变化为-1价,2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O可知,反应前铁、氧、氢、钠、氯的原子个数分别是:2、13、10、7、3,反应后铁、氧、氢、钠、氯的原子个数分别是:2、13、10、4、0,所以每个X中含有1个钠离子和1个氯离子,X是氯化钠,氢氧化铁中铁元素化合价升高被氧化,
故答案为:NaCl,Fe(OH)3;
Ⅱ、硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2.
故答案为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;SiO2;
(2)FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+,
故答案为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+;
(3)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,如果加NaOH调节溶液的pH=a,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-a}}$,25℃时,Ksp[Fe(OH)3]=4×10-38 ,则滤液B中的c(Fe3+)=$\frac{Ksp}{{c}^{3}(O{H}^{-})}$=$\frac{4×1{0}^{-38}}{(\frac{1{0}^{-14}}{1{0}^{-a}})^{3}}$=4×10(4-3a),
故答案为:3.2~3.8,4×10(4-3a);
(4)根据几种离子沉淀的pH,如果pH过大,Al3+、Mg2+形成沉淀,使制得的铁红不纯;未沉淀的离子为Na+、Mg2+、Al3+,故滤液B可以回收的物质有Na2SO4、Al2(SO4)3、MgSO4,
故答案为:Na2SO4、Al2(SO4)3、MgSO4.
点评 本题通过制备铁红,考查了物质制备方案的设计及化学实验基本操作方法的综合应用,题目难度中等,明确制备流程及化学实验基本操作方法为解答关键,试题充分考查了学生的分析、理解能力及化学实验能力.

| A. | 原子半径:Te>Cl>S | B. | 热稳定性:H2Te>H2S>PH3 | ||
| C. | 还原性:Cl->S2->Te2- | D. | 酸性:HClO4>H2SO4>H2TeO4 |
(已知Ksp[Fe(OH)3]=3.8×10-38; Ksp[Cu(OH)2]=2×10-20;Ksp(ZnS)=1.6×10-24)
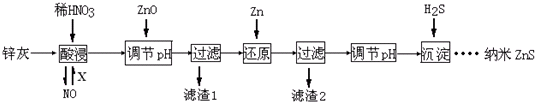
下列说法不正确的是( )
| A. | 酸浸时FeO与稀HNO3反应的离子方程式为3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | 将酸浸的尾气循环利用,加入的X气体可以是O2 | |
| C. | 滤渣2中的成分和Zn和Fe | |
| D. | 当溶液中Zn2+浓度为小于1.0×10-5mol•L-1时,则可认为其沉淀完全.若要使Zn2+沉淀完全,溶液中S2-浓度应大于1.6×10-19mol•L-1 |
| A. | FeO | B. | Fe3O4 | ||
| C. | Fe2O3 | D. | Fe3O4 和Fe2O3混合物 |
 O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2 CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是
CH3OH(g)过程中的能量变化情况如下图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是