8.有关化学用语的表示正确的是( )
| A. | 甲烷分子的比例模型是: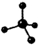 | B. | 二氧化碳的电子式: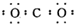 | ||
| C. | CO2的比例模型: | D. | HClO的结构式为:H-O-Cl |
5.金属在生产、生活中的应用十分广泛.
I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
(1)写出实验a的反应的离子方程式:2Na+2H2O═2Na++2OH-+H2↑
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.
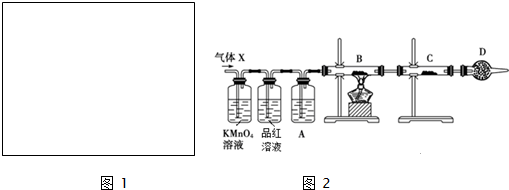
Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
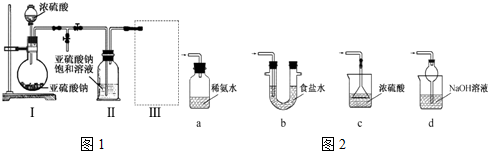
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a.取已切去表皮的一小块金属钠,放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c.向两支盛有3mL 2mol•L-1硫酸的试管中加入大小相同的镁条和铝片 | 镁、铝与硫酸反应产生气泡剧烈程度不同 | 镁与硫酸反应产生气泡速率较快 |
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.

Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
4.常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
分析实验记录,甲认为导致Fe3+浓度过低的原因是加入氯化铁的量过少,导致铁离子浓度过小;乙同学结合平衡移动的知识,认为还有一个原因是用四氯化碳萃取碘,促进平衡正向移动,导致铁离子浓度过小.
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池
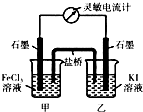
①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mLCCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是上层溶液呈血红色,加入四氯化碳的作用是萃取碘单质,排除对后续实验颜色观察的干扰.
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)现将反应2Fe3++2I-?2Fe2++I2设计成图所示的原电池

①能说明反应达到平衡的标志是ad(填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时甲(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为2Fe2+-2e-=2Fe3+.
19.下列对应化学反应的离子方程式正确的是( )
| A. | 向磷酸二氢铵溶液中加入足量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | FeSO4溶液在空气中放置变质:4Fe2++O2+2H2O═4Fe3++4OH- | |
| D. | 过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ |
18.某“84消毒液”的包装说明如下:
下列说法不正确的是( )
0 169786 169794 169800 169804 169810 169812 169816 169822 169824 169830 169836 169840 169842 169846 169852 169854 169860 169864 169866 169870 169872 169876 169878 169880 169881 169882 169884 169885 169886 169888 169890 169894 169896 169900 169902 169906 169912 169914 169920 169924 169926 169930 169936 169942 169944 169950 169954 169956 169962 169966 169972 169980 203614
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |

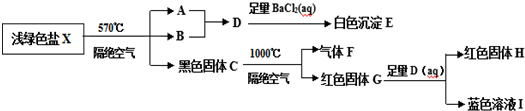
 .
.

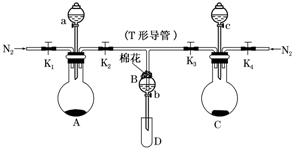 某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).
某实验小组用如图所示装置进行实验以探究Fe3+、Cl2和SO2的氧化性强弱(夹持仪器已略).