题目内容
5.金属在生产、生活中的应用十分广泛.I.某研究性学习小组在探究钠、镁、铝金属性强弱的过程中设计了以下探究性实验方案,请填写下列空白:
实验用品:酒精灯、烧杯、试管、试管夹、砂纸、滤纸;
钠、镁条、铝片、酚酞、蒸馏水、2mol•L-1的硫酸
方案如下表:
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a.取已切去表皮的一小块金属钠,放入盛有水的烧杯中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b.向盛有适量水(内含2滴酚酞)的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c.向两支盛有3mL 2mol•L-1硫酸的试管中加入大小相同的镁条和铝片 | 镁、铝与硫酸反应产生气泡剧烈程度不同 | 镁与硫酸反应产生气泡速率较快 |
(2)你认为a、b两步实验中出现异常现象的可能原因是:
a.钠表面的煤油没有用滤纸吸干净;
b.镁条表面的氧化膜没有被除去.
(3)下列措施不能提高镁条与硫酸反应产生氢气的速率的是AE
A.改用18mol•L-1的硫酸 B.加入少量硫酸铜
C.改用镁粉 D.升高温度 E.增大压强
Ⅱ.根据以上实验知道,镁比铝活泼,甲同学突发奇想,想设计一个原电池,让镁不腐蚀而铝腐蚀.请你帮他实现这个设想,在下面方框中画出装置图1,并写出负极电极反应式.
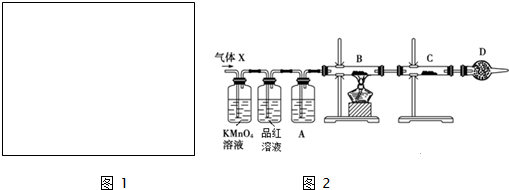
Ⅲ.工业上常用铝质容器盛装冷的浓硫酸,为研究铝质材料与热浓硫酸的反应,乙同学进行了以下探究活动:
(1)取铝片6.0g放入15.0mL浓硫酸中,加热,充分反应后收集到气体X.取448ml(标准状况)气体X通入足量过氧化氢溶液中,然后再加入足量BaCl2溶液,经适当操作后得干燥固体2.33g,由于此推知气体X中SO2的体积分数为50%.
(2)分析上述实验中SO2体积分数的结果,丙同学认为气体X中还可能含量有H2.为此设计了下列探究实验装置(图2中夹持仪器省略).
①A中加入的试剂可能是浓硫酸
②若B中装氧化铜,C中装无水硫酸铜,则可以证明气体X中含有氢气的实验现象是B中固体由黑变红和C中固体由白变蓝.
分析 Ⅰ、(1)实验a的反应为钠和水发生反应生成氢氧化钠和氢气;
(2)煤油阻止钠和水反应;镁易被氧气氧化生成MgO;
(3)增大金属与酸反应的化学反应速率,可通过增大浓度、升高温度或形成原电池反应等措施,注意原电池反应会加快反应速率;
Ⅱ、根据原电池原理,Al失电子发生氧化反应作负极、Mg作正极,氢氧化钠溶液为电解质溶液;负极上Al失电子发生氧化反应;
Ⅲ、(1)双氧水将二氧化硫氧化成硫酸,2.33g白色沉淀为硫酸钡,根据原子守恒计算出二氧化硫的物质的量,再计算出二氧化硫的体积分数;
(2)①根据实验目的是检验二氧化硫中混有氢气,所以装置A的作用是将二氧化硫除去,据此进行判断合理的试剂;
②氢气还原氧化铜生成水蒸气遇到无水硫酸铜会使硫酸铜变蓝色;
解答 解:I.(1)实验a的反应为钠和水发生反应生成氢氧化钠和氢气,反应的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑;
故答案为:2Na+2H2O═2Na++2OH-+H2↑;
(2)钠表面如果有煤油时,煤油阻止Na和水反应,所以刚开始没有明显现象;镁易被氧气氧化生成MgO,氧化镁和水不反应,MgO阻止Mg和热水反应,所以加热实验装置没有预期现象,
故答案为:钠表面的煤油没有用滤纸吸干净;镁表面的氧化膜没有被除去;
(3)A.改用18mol•L-1的硫酸,和镁反应不能生成氢气,不能加快生成氢气的速率,故A符合;
B.加入少量硫酸铜和镁反应生成铜附着在镁条在溶液中形成原电池反应,加快反应速率,故B不符合;
C.改用镁粉,增大接触面积,加快反应速率,故C不符合;
D.升高温度增大反应速率,故D不符合;
E.该反应的实质是铁与氢离子反应,反应物中没有气体,则增大压强对反应速率无影响,故E符合;
故答案为:AE;
Ⅱ.根据原电池原理,Al活泼性比Mg差,若是Al失电子发生氧化反应作负极、Mg作正极,需要氢氧化钠溶液为电解质溶液;负极上Al失电子发生氧化反应,也可以设计盐桥组成原电池,装置图为: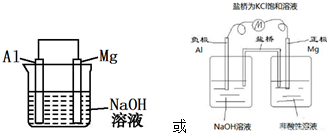 ,负极:2Al-6e-+8OH-═2AlO2-+4H2O,
,负极:2Al-6e-+8OH-═2AlO2-+4H2O,
故答案为: ;2Al-6e-+8OH-═2AlO2-+4H2O;
;2Al-6e-+8OH-═2AlO2-+4H2O;
Ⅲ.(1)SO2具有还原性,通入足量双氧水中,SO2被氧化成H2SO4,生成的硫酸遇到氯化钡会产生白色沉淀,则n(混合气体)=$\frac{0.448L}{22.4L/mol}$=0.02mol;
SO2 ~BaSO4
1mol 233g
n 2.33g
n=0.01mol
所以二氧化硫的体积分数为:$\frac{0.01mol}{0.02mol}$×100%=50%,
故答案为:50%;
(2)①装置A中盛放的是浓硫酸,用于干燥除去二氧化硫的后的气体,防止气体中的水蒸气加入装置B导致大试管断裂;装置C用于检验反应产物是否有水分生成,所以必须使用碱石灰吸收空气中的水蒸气,防止空气中得水蒸气进入C装置中干扰氢气的检验,
故答案为:浓硫酸;
②如果混合气体中含有氢气,则B中固体CuO由黑变红,同时装置C中无水硫酸铜固体由白变蓝,
故答案为:B中固体由黑变红和C中固体由白变蓝.
点评 本题考查了金属铝及其化合物性质、浓硫酸的性质、常见气体的检验,题目难度中等,注意掌握铝及其化合物的性质、浓硫酸的化学性质,明确常见气体的性质及检验方法.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案| A. | c(NH4+):③>② | |
| B. | Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)右移 | |
| C. | pH:③>②>① | |
| D. | 将等体积的①和③混合,所得溶液中 c(Cl-)+c(CH3COO-)=c(NH4+)+c(H+) |
| A. | 向磷酸二氢铵溶液中加入足量氢氧化钠溶液:NH4++OH-═NH3•H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | |
| C. | FeSO4溶液在空气中放置变质:4Fe2++O2+2H2O═4Fe3++4OH- | |
| D. | 过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ |
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1mol•L-1 的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-389.9kJ•mol-1 | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2kJ•mol-1 | |
| C. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1299.6kJ•mol-1 | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-1299.6kJ•mol-1 |
| A. | 麦芽糖在人体内的水解产物能和银氨溶液发生反应 | |
| B. | 在鸡蛋清溶液中加入饱和的Na2SO4溶液时,会使蛋白质析出 | |
| C. | 淀粉、纤维素、蛋白质和油脂都是有机高分子化合物 | |
| D. | 在一定条件下氨基酸之间能发生反应,合成更复杂的化合物(多肽),构成蛋白质 |
| A. | 使用Cu-Zn-Fe催化剂可大大提高CH3CH2OH的产率 | |
| B. | 反应需在300℃进行可推测出该反应为吸热反应 | |
| C. | 充入大量CO2气体可提高H2的转化率 | |
| D. | 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率 |
 镁化合物具有广泛用途,请回答有关镁的下列问题:
镁化合物具有广泛用途,请回答有关镁的下列问题: